रासायनिक आबंधन तथा आण्विक संरचना
रासायनिक आबंधन तथा आण्विक संरचना
तत्वों की रासायनिक प्रकृति एवं संयोजकता उन तत्वों के इलेक्ट्रॉनिक विन्यास पर निर्भर करती है। तत्वों के बाह्य कोश को संयोजकता कोश कहते हैं। एवं बाह्य कोश के इलेक्ट्रॉनों को संयोजकता इलेक्ट्रॉन (valence electron in Hindi) कहते हैं। चूंकि किसी अणु के बनने में परमाणुओं के केवल बाह्य कोश के इलेक्ट्रॉन ही भाग लेते हैं।
अमेरिकी वैज्ञानिक जी. एन. लुईस ने परमाणु में संयोजकता इलेक्ट्रॉनों को निरूपित करने के लिए एक सरल संकेतनों को प्रस्तुत किया जिन्हें लुईस प्रतीक कहते हैं।
उदाहरण – आवर्त सारणी के दूसरे आवर्त के तत्वों के लुईस प्रतीक निम्न प्रकार से हैं।
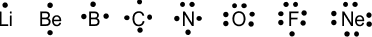
Note – तत्वों के चारों ओर बिंदु परमाणु के संयोजकता इलेक्ट्रॉन की संख्या को प्रदर्शित करते हैं। अर्थात् तत्वों के बाह्य कोश में इलेक्ट्रॉनों की संख्या को दर्शाते हैं जैसे –

महत्वपूर्ण बिंदु
- जिन तत्वों की बाह्यतम कोश में 8 इलेक्ट्रॉन होते हैं। वह रासायनिक रूप से निष्क्रिय हो जाते हैं। अर्थात अक्रिय गैस होते हैं।
- हाइड्रोजन आबंध, वांडरवाल्स बलों की तुलना में दुर्बल होता है।
- सहसंयोजी यौगिक आयनित नहीं होते हैं। अतः यह विलयन या गलित अवस्था में विद्युत के कुचालक होते हैं।
- PCl5 में sp3d संकरण होता है। जिसकी आकृति त्रिकोणीय द्विपिरामिडी होती है।
