विद्युत रसायन (Electrochemistry)
विद्युत रसायन (Electrochemistry)
विद्युत रसायन (Electrochemistry)
विद्युत रसायन स्वतः प्रवर्तित (spontaneous) रासायनिक अभिक्रियाओं में निर्गमित (released) ऊर्जा से विद्युत उत्पादन एवं विद्युतीय ऊर्जा के स्वतः अप्रवर्तित (non-spontaneous) रासायनिक परिवर्तनों में उपयोग का अध्ययन है। बहुत सारी धातुएँ, सोडियम हाइड्रॉक्साइड, क्लोरीन, फ्लुओरीन एवं अन्य बहुत सारे रसायन, विद्युत रासायनिक विधियों द्वारा बनाए जाते हैं।
विद्युत अपघटन (Electrolysis)
इलेक्ट्रोलिसिस (electrolysis) शब्द दो शब्दों इलेक्ट्रो (electro) अर्थ ‘विद्युत ऊर्जा’ तथा लिसिस (lysis) अर्थ ‘विघटन’ से लिया गया है। किसी पदार्थ की गलित अवस्था या इसके जलीय विलयन में विद्युत धारा प्रवाहित करने पर अपघटित होने की प्रक्रिया को विद्युत अपघटन कहते हैं। दूसरे शब्दों में विद्युत अपघटन वह प्रक्रिया है, जिसमें विद्युत ऊर्जा का उपयोग स्वतः अप्रवर्तित रासायनिक अभिक्रियाओं को कराने में किया जाता है। विलियम निकोलसन ने जल के विद्युत अपघटन को दर्शाया था।
विद्युत अपघटन के लिए आवश्यक अवयव (Components Required for Electrolysis)
विद्युत अपघटन की प्रक्रिया के लिए तीन आवश्यक अवयव हैं
(i) विद्युत अपघट्य (Electrolyte) वे पदार्थ जो द्रवित अवस्था में या जलीय विलयन में विद्युत का संचालन करते हैं विद्युत अपघट्य कहलाते हैं। जैसे अम्ल, क्षारक और लवण आदि।
अपघटन (वियोजन) के आधार पर विद्युत अपघट्य दो प्रकार के होते हैं; प्रबल विद्युत अपघट्य और दुर्बल विद्युत अपघट्य | प्रबल विद्युत अपघट्य अपने आयनों में लगभग पूर्णतः वियोजित हो जाते हैं जबकि दुर्बल विद्युत अपघट्य अपने आयनों में आंशिक वियोजित होते हैं। उदाहरण सोडियम क्लोराइड (NaCl), पौटेशियम क्लोराइड (KCI), कैल्सियम क्लोराइड (CaCl2) तथा मैग्नीशियम सल्फेट (MgSO4) प्रबल विद्युत अपघट्य हैं, जबकि ऐसीटिक अम्ल दुर्बल विद्युत अपघट्य है।
◆ वे पदार्थ जो द्रवित अवस्था में या जलीय विलयन में विद्युत का संचालन नहीं करते विद्युत अपघट्य कहलाते हैं।
◆ विद्युत अनपघट्य ऊष्मा के कुचालक होते हैं, क्योंकि जल में घोले जाने पर ये अपने आयनों में वियोजित नहीं होते हैं। जैसे यूरिया, ग्लूकोस, चीनी आदि ।
(ii) विद्युत धारा ( Electric Current) किसी चालक में इलेक्ट्रॉनों का प्रवाह विद्युत धारा कहलाता है। इसके परिणाम स्वरूप संगत (respective) टर्मिनलों पर आयनों का स्थानान्तरण होता है।
(iii) इलेक्ट्रोड (Electrode) किसी विद्युत अपघटनी या गैल्वेनी सेल में उपस्थित धात्विक छड़ को इलेक्ट्रोड कहते हैं। ये दो प्रकार के होते हैं; कैथोड (ऋणावेशित) तथा ऐनोड (धनावेशित)। ये इलेक्ट्रोड टर्मिनल की भाँति कार्य करते हैं।
विद्युत अपघट्यों के विघटन का आरहेनियस सिद्धान्त (Arrhenius Theory of Electrolytic Dissociation or Decomposition)
जलीय विलयन में विद्युत अपघट्यों के व्यवहार की व्याख्या करने के लिए स्वीडन के रसायनज्ञ स्वांटे आरहेनियस ने 1894 में इस सिद्धान्त को प्रतिपादित किया था। इस सिद्धान्त की मुख्य अभिधारणाएँ निम्न प्रकार हैं
(i) जब कोई विद्युत अपघट्य जल में घोला जाता है, तो यह अपने आयनों, धनायनों (धनावेशित) और ऋणायनों (ऋणावेशित) में विघटित हो जाता है यह प्रक्रिया आयनन कहलाती है।
(ii) सामान्य दशाओं में, दुर्बल विद्युत अपघट्य अपने विलयन में कुछ सीमा तक विघटित होते हैं तथा इन विद्युत अपघट्यों के विलयन में आयन होते हैं, जो अनायनित अणुओं के साथ साम्य में होते हैं।
जैसे 
इस प्रकार साम्य आयनिक साम्य (ionic equilibrium) कहलाता है।
(iii) अणुओं की कुल संख्या का अंश जो विघटन में भाग लेता है वियोजन या विघटन की मात्रा (degree of dissociation) अथवा आयनन की मात्रा ( degree of ionisation) कहलाता है।

(iv) विद्युत अपघटन केवल इलेक्ट्रोडों पर होता है।
(v) किसी विलयन की चालकता विलयन में उपस्थित आयनों की संख्या पर निर्भर करती है।
फैराडे के विद्युत अपघटन के नियम (Faraday’s Laws of Electrolysis)
माइकल फैराडे ने विद्युत अपघटन की परिघटना पर अनेकों प्रयोग किए और उनके परिणामों को 1833-34 प्रकाशित किया। इन प्रयोगों के आधार पर, फैराडे ने निम्नलिखित दो नियम दिए जिन्हें फैराडे के विद्युत अपघटन के में नियम कहते हैं ।
1. प्रथम नियम (First Law)
विद्युत धारा द्वारा विद्युत अपघटन में रासायनिक विघटन की मात्रा विद्युत अपघट्य (विलयन या गलित) में प्रवाहित धारा की मात्रा के समानुपाती होती है।

अतः किसी पदार्थ का विद्युत रासायनिक तुल्यांक पदार्थ के रासायनिक तुल्यांक के समानुपाती होता है।
◆ फैराडे 96487 कूलॉम विद्युत धारा किसी विलयन में से प्रवाहित करने पर पदार्थ का 1 तुल्यांकी भार मुक्त होता है, विद्युत धारा की इस मात्रा को फैराडे (F) कहते हैं।
1F = 96500 कूलॉम मोल-1
◆ वास्तव में यह (1F) 1 मोल इलेक्ट्रॉनों पर आवेश है इसका सही मान 96487 कूलॉम मोल-1 है।
विद्युत अपघटन के उत्पाद (Products of Electrolysis)
विद्युत अपघटन के उत्पाद अपघटित होने वाले पदार्थों की अवस्था तथा प्रयुक्त इलेक्ट्रोडों के प्रकार पर निर्भर करते हैं। उदाहरण यदि हम गलित NaCl का प्रयोग करें तो विद्युत अपघटन के उत्पाद सोडियम धातु एवं क्लोरीन होंगे। सोडियम क्लोराइड के जलीय विलयन के विद्युत अपघटन के दौरान NaOH, Cl2 एवं H2 उत्पाद बनते हैं। कॉपर सल्फेट के जलीय विलयन के विद्युत अपघटन में कॉपर इलेक्ट्रोडों का प्रयोग करने से कैथोड पर कॉपर धातु प्राप्त होती है।
विद्युत अपघटन के उत्पाद विद्युत अपघटनी सेल में उपस्थित विभिन्न ऑक्सीकारक एवं अपचायक स्पीशीज एवं उनके मानक इलेक्ट्रोड विभवों पर निर्भर करते हैं।
◆ इलेक्ट्रॉड एवं विद्युत अपघट्य के मध्य जो विभावन्तर उत्पन्न होता है, वह इलेक्ट्रॉड विभव (electrode potential) कहलाता है।
◆ जब अर्द्धसेल अभिक्रिया में प्रयुक्त सभी स्पीशीज़ की सान्द्रता केवल एक इकाई होती है, तो इलेक्ट्रॉड विभव को मानक इलेक्ट्रॉड विभव ( standard electrode potential) कहते हैं।
विद्युत अपघटन के अनुप्रयोग (Applications of Electrolysis)
ये इस प्रकार हैं
(i) धातुओं के विद्युत परिष्करण में (In Electrorefining of Metals) कॉपर, सिल्वर, गोल्ड आदि धातुएँ शुद्ध अवस्था में विद्युत परिष्करण विधि द्वारा प्राप्त की जाती हैं जिसमें अशुद्ध धातु का ऐनोड तथा उसी धातु की शुद्ध पट्टी को कैथोड की तरह प्रयुक्त करते हैं धातु के लवण का जलीय विलयन विद्युत अपघट्य की तरह प्रयुक्त किया जाता है। इस विधि से 99.9% शुद्ध कॉपर प्राप्त किया जाता है।
(ii) वस्तुओं के विद्युत लेपन में (In Electroplating Objects) विद्युत लेपन विद्युत अपघटन की वह प्रक्रिया है, जिसमें किसी वांछित धातु की परत किसी दूसरे पदार्थ को संक्षारण व खरोचों से सुरक्षित रखने के लिए तथा चमक प्रदान करने के लिए निक्षेपित की जाती है। अनेकों वस्तुओं जैसे कार के पुर्जों आदि पर क्रोमियम का लेपन किया जाता है। आभूषण निर्माता सिल्वर, कॉपर या निकैल के आभूषणों को गोल्ड के लवण के विलयन में रखकर विद्युत धारा प्रवाहित करके इन पर गोल्ड का लेपन करते हैं। टिन कैन (डिब्बे) जिनका प्रयोग भोजन के भण्डारण में किया जाता है लोहे पर टिन के विद्युत लेपन द्वारा बनाई जाती है।
(iii) विद्युत मुद्रण में (In Electrotyping) यह मुद्रण उद्योग में ब्लॉक (blocks) ग्राफिक्स (graphics) आदि के निर्माण में प्रयुक्त होती है। जैसे बड़े प्रिंटिंग प्रेसों में ताँबे के वोल्टमीटर में कैथोड की जगह प्रिंटिंग पेपर रखकर प्रिंटिंग पेपर पर कॉपर की पतली परत चढ़ाई जाती है क्योंकि कॉपर चढ़े प्रिंटिंग पेपर पर बहुत अच्छी छपाई होती है।
(iv) विद्युत धातुकर्म में (In Electrometallurgy) यह कुछ धातुओं जैसे कैल्सियम, ऐलुमिनियम, मैग्नीशियम आदि की इनके संगत यौगिकों से निष्कर्षण की विधि है।
(v) रासायनिक यौगिकों के निर्माण में (In the Manufacturing of Compounds) रासायनिक यौगिकों जैसे क्लोरोफॉर्म, एथेन, ऐसीटिलीन, औषधियाँ आदि का विद्युत अपघटन विधि द्वारा निर्माण किया जाता है।
(vi) धातुओं के तुल्यांकी भार ज्ञात करने में (In the Evaluation of Equivalent Weight of the Metals) धातुओं के तुल्यांकी भार W ∝ E सूत्र का प्रयोग करके ज्ञात किए जाते हैं।
(vii) विद्युतीय संधारित्रों में (In Electrolytic Capacitor or Condensor) इनमें ऐलुमिनियम धातु का प्रयोग दोनों इलेक्ट्रोडों को बनाने में किया जाता है। बोरिक अम्ल, ग्लिसरीन और जलीय अमोनिया के मिश्रण का प्रयोग विद्युत अपघट्य के रूप में किया जाता है। विद्युत धारा प्रवाहित करने पर ऐनोड पर ऐलुमिनियम हाइड्रॉक्साइड की परत निक्षेपित हो जाती है यह इलेक्ट्रोडों के लिए पराविद्युत (dielectric) का कार्य करती है।
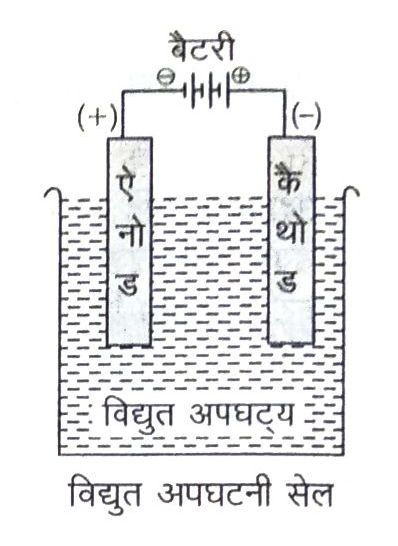
विद्युत अपघटनी सेल (Electrolytic Cell)
एक पात्र जिसमें विद्युत अपघटन किया जाता है विद्युत अपघटनी सेल कहलाता है। विद्युत अपघटनी सेल में दो धातु की छड़ें होती हैं जिन्हें इलेक्ट्रोड कहते हैं। इलेक्ट्रोड जो बैटरी के धन टर्मिनल से जुड़ा होता है वह ऐनोड कहलाता है तथा जो बैटरी के ऋण टर्मिनल से जुड़ा होता है उसे कैथोड कहते हैं। दोनों इलेक्ट्रोड विद्युत अपघट्य के विलयन में डूबे रहते हैं। विद्युत अपघट्य में विद्युत धारा प्रवाहित करने पर ऑक्सीकरण (इलेक्ट्रॉनों का मुक्त होना) ऐनोड पर तथा अपचयन (इलेक्ट्रॉनों की लब्धि) कैथोड पर होता है।
गैल्वेनी सेल या वोल्टीय सेल (Galvanic Cell or Voltaic Cell)
गैल्वेनी सेल एक विद्युत रासायनिक सेल है, जो एक स्वतः प्रवर्तित रेडॉक्स अभिक्रिया में उत्सर्जित रासायनिक ऊर्जा को विद्युत ऊर्जा में परिवर्तित कर देती है। डेनियल सेल गैल्वेनी सेल का एक प्रायोगिक और प्रारूपिक उदाहरण है। डेनियल सेल में ऐनोड जिंक छड़ का बना होता है, जो जिंक सल्फेट के विलयन विद्युत अपघट्य में डूबी रहती है। इसी में प्रकार कैथोड कॉपर छड़ का बना होता है, जो कॉपर सल्फेट में डूबी रहती है। जब जिंक और कॉपर इलेक्ट्रोड़ों को तार द्वारा जोड़ दिया जाता है, तो विद्युत धारा प्रवाहित होती है। जिंक की छड़ का द्रव्यमान घटता है जबकि कॉपर छड़ का द्रव्यमान बढ़ता है।
विद्युत रासायनिक श्रेणी (Electrochemical Series)
विभिन्न इलेक्ट्रोड़ों के मानक इलेक्ट्रोड विभवों को बढ़ते हुए क्रम में रखने पर जो श्रेणी प्राप्त होती है उसे विद्युत रासायनिक श्रेणी कहते हैं। हाइड्रोजन का इलेक्ट्रोड विभव शून्य होता है।
इस श्रेणी में हाइड्रोजन मध्य में रखी गई है। हाइड्रोजन की अपेक्षा जो तत्व अच्छे अपचायक हैं वे हाइड्रोजन से ऊपर अपना स्थान पाते हैं तथा जो तत्व हाइड्रोजन की अपेक्षा अच्छे ऑक्सीकारक हैं वे हाइड्रोजन से नीचे अपना स्थान पाते हैं।
विद्युत रासायनिक श्रेणी Li, K, Ba, Ca, Na, Mg, Al, Zn, Cr, Fe, Co, Cd, Ni, Sn, H2, Cu, I2, Hg, Ag, Pd, Br2, Cl2, Au, E2 l
विद्युत रासायनिक श्रेणी के लक्षण (Characteristics of Electrochemical Series)
इसके प्रमुख लक्षण निम्न प्रकार हैं
(i) अपचयन विभव का मान जितना कम होगा उतनी अधिक इसकी अपचायक क्षमता होगी।
(ii) धातु जिनके अपचयन विभव कम (ऋणात्मक) होते हैं वे उच्च अपचयन विभव (धनात्मक) वाली धातुओं को उनके लवण के विलयनों में से विस्थापित कर देती हैं। अर्थात् श्रेणी में नीचे स्थित धातुओं की अपेक्षा श्रेणी में ऊपर स्थित धातुएँ अधिक सक्रिय हैं।
(iii) श्रेणी में जो धातुएँ हाइड्रोजन से ऊपर स्थित हैं वे H+ आयन वाले किसी भी विलयन में से हाइड्रोजन को विस्थापित करने की योग्यता रखते हैं।
(iv) इलेक्ट्रोड विभव जितना अधिक ऋणात्मक होगा, आयन बनाने की प्रवृत्ति उतनी अधिक होगी।
(v) इस श्रेणी की सहायता से हम तत्वों के ऑक्सीकारक और अपचायक व्यवहार की तुलना कर सकते हैं।
बैटरियाँ (Batteries)
कोई भी बैटरी (वास्तव में इसमें एक या एक से अधिक सेल श्रेणीबद्ध रहते हैं) या सेल जिसे हम विद्युत के स्रोत के रूप में प्रयोग में लाते हैं, मूलतः एक गैल्वेनी सेल है, जो रेडॉक्स अभिक्रिया की रासायनिक ऊर्जा को विद्युत ऊर्जा में बदल देती है। वास्तव में बैटरियों में ऊर्जा रासायनिक ऊर्जा के रूप में भण्डारित होती है। जब इन्हें किसी भी सर्किट के साथ जोड़ा जाता है, तो भण्डारित रासायनिक ऊर्जा धीरे-धीरे स्थिरता के साथ विद्युत ऊर्जा में परिवर्तित होती है।
बैटरियाँ मुख्यतः दो प्रकार की होती हैं
1. प्राथमिक बैटरियाँ (Primary Batteries)
प्राथमिक बैटरियों में अभिक्रिया केवल एक बार होती है तथा कुछ समय तक प्रयोग के बाद प्राथमिक बैटरी निष्क्रिय हो जाती है एवं पुनः प्रयोग में नहीं लाई जा सकती। इनके सबसे चिर परिचित उदाहरण इस प्रकार है।
(i) शुष्क सेल (Dry Cell) इसे लैक्लांशे सेल (Leclanche cell) के नाम से इसके अविष्कारक के नाम पर जाना जाता है। ये सामान्य रूप में ट्रान्जिस्टरों एवं घड़ियों में प्रयोग में लाई जाती है। इस सेल में जिंक का एक पात्र होता है, जो ऐनोड का कार्य भी करता है तथा कार्बन (ग्रेफाइट) की छड़ जो चारों ओर से चूर्णित मैंगनीज डाइऑक्साइड तथा कार्बन से घिरी रहती है, कैथोड का कार्य करती है । इलेक्ट्रोडों के बीच का स्थान अमोनियम क्लोराइड (NH4 Cl) तथा जिंक क्लोराइड (ZnCl2) के नम पेस्ट से भरा होता है।
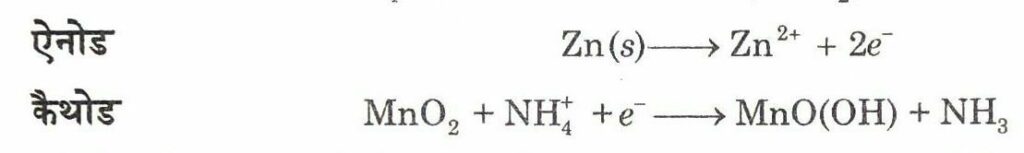
अभिक्रिया में उत्पन्न अमोनिया Zn2+ के साथ संकुल (complex) बनाती है। MnO2 विध्रुवक का कार्य करता है। सेल का विभव लगभग 1.5 वोल्ट होता है।
(ii) मर्करी सेल (Mercury Cell) यह श्रवण यन्त्र, घड़ियों आदि जैसी विद्युत् की कम मात्रा की आवश्यकता वाली युक्तियों के लिए उपयुक्त होती है। इसमें जिंक मर्वयूरी अमलगम ऐनोड का तथा HgO एवं कार्बन का पेस्ट कैथोड का कार्य करता है। KOH और ZnO का पेस्ट विद्युत अपघट्य होता है। सेल की इलेक्ट्रोड अभिक्रियाएँ इस प्रकार हैं
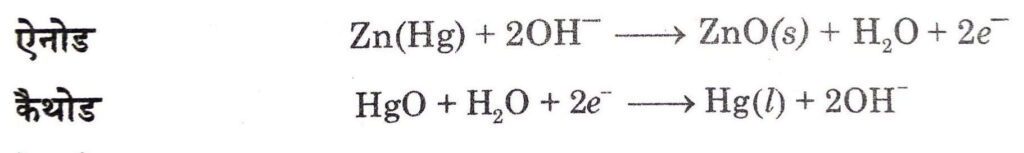
सेल विभव लगभग 1.35 वोल्ट होता है तथा सम्पूर्ण कार्य अवधि में स्थिर रहता है।
2. द्वितीयक बैटरियाँ (Secondary Batteries)
एक संचायक सेल को उपयोग के बाद विपरीत दिशा में विद्युत धारा के प्रवाह द्वारा पुनः आवेशित कर फिर से प्रयोग में लाया जा सकता है। सबसे महत्त्वपूर्ण संचायक सेल लेड संचायक बैटरी तथा Ni-Cd बैटरी हैं।
(i) लेड संचायक बैटरी (Lead Storage Battery ) यह सामान्यतः वाहनों और इन्वर्टरों में प्रयुक्त की जाती है। इसमें ऐनोड लेड का बना होता है तथा कैथोड लेड डाइऑक्साइड (PbO2) से भरे हुए लेड का ग्रिड होता है। 38% सल्फ्यूरिक अम्ल का विलयन विद्युत अपघट्य का कार्य करता है।

बैटरी को आवेशित करने पर (जब यह विद्युत अपघटनी सेल की तरह कार्य करती है) अभिक्रिया उत्क्रमित हो जाती है तथा PbSO4 (s) ऐनोड एवं कैथोड पर क्रमशः Pb एवं PbO2 में बदल जाते हैं।
इसमें 6 सेल होते हैं और प्रत्येक का विभव 2 वोल्ट होता है अतः इसका कुल वोल्टेज 12 वोल्ट होता है। इसकी क्षमता ऐम्पियर-घण्टा में निरूपित की जाती है जल के निर्माण के कारण सेल का घनत्व (विशिष्ट गुरूत्व) घट जाती है और सेल डिस्चार्ज हो जाती है। पूर्ण आवेशित सेल का विद्युत वाहक बल 2.2 वोल्ट तथा डिस्चार्ज सेल का विद्युत वाहक बल 1.8 वोल्ट होता है। सेल के अनावेशन (डिस्चार्ज) की स्थिति को सल्फेटिंग कहते हैं।
(ii) Ni Cd सेल (Ni Cd Cell) इसकी कार्य अवधि लेड संचायक बैटरी से अधिक है किन्तु इसकी निर्माण लागत अधिक है। यह टॉर्चलाइट, इलेक्ट्रिक शेवर आदि युक्तियों में प्रयुक्त होती है।
◆ आजकल Ni-MH (निकेल मेटल हाइड्राइड) बैटरियाँ काफी प्रयुक्त की जाती हैं इनकी 25% अधिक कार्य अवधि है और ये Ni Cd (Ni-Cd) बैटरी की अपेक्षा कम हानिकारक हैं।
◆ गर्मियों में बार-बार चार्जिंग की आवश्यकता होती है क्योंकि उच्च ताप पर बैटरी की स्वयं डिस्चार्ज होने की दर बढ़ जाती है।
सेल दक्षता (Cell Efficiency)
यह सेल द्वारा किए गए लाभदायक कार्य तथा कुल किए गए कार्य का अनुपात है यदि किसी सेल का विद्युत वाहक बल E तथा बन्द परिपथ में सेल के टर्मिनलों के बीच विभवान्तर V हो, तो

हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here