रासायनिक बलगतिकी और साम्यावस्था (Chemical Kinetics and Equilibrium)
रासायनिक बलगतिकी और साम्यावस्था (Chemical Kinetics and Equilibrium)
रासायनिक बलगतिकी और साम्यावस्था (Chemical Kinetics and Equilibrium)
रासायनिक बलगतिकी (Chemical Kinetics)
Kinetics (बलगतिकी) शब्द की व्युत्पत्ति ग्रीक भाषा के शब्द ‘Kinesis’ से हुई है, जिसका अर्थ है ‘गति’ । रासायनिक बलगतिकी रसायन विज्ञान की वह शाखा है, जिसमें अभिक्रिया का वेग, अभिक्रिया के वेग को प्रभावित करने वाले कारक तथा अभिक्रिया की क्रियाविधि का अध्ययन किया जाता है।
दूसरे शब्दों में, रासायनिक बलगतिकी रासायनिक अभिक्रिया में अभिक्रिया वेग, विभिन्न कारकों का प्रभाव, परमाणुओं की पुनर्व्यवस्था तथा मध्यवर्ती के बनने का अध्ययन है।
मन्द तथा तीव्र अभिक्रियाएँ (Slow and Fast Reactions)
कुछ अभिक्रियाएँ, जैसे आयनिक अभिक्रियाएँ अत्यधिक तीव्र गति से होती हैं इसलिए तीव्र अभिक्रियाएँ कहलाती हैं। जैसे सिल्वर क्लोराइड का अवक्षेपण सिल्वर नाइट्रेट तथा सोडियम क्लोराइड के जलीय विलयन को मिलाने पर अतिशीघ्र हो जाता है।

दूसरी ओर कुछ अभिक्रियाएँ पूर्ण होने में कुछ दिन, महीने और वर्ष लेती हैं, ऐसी अभिक्रियाएँ मन्द अभिक्रियाएँ कहलाती हैं। जैसे वायु व आर्द्रता (moisture) की उपस्थिति में लोहे पर जंग (rust) लगना।
कुछ अभिक्रियाएँ ऐसी भी होती हैं जो मध्यम वेग से होती हैं जैसे इक्षु-शर्करा का प्रतिलोमन (inversion of cane sugar) तथा स्टार्च का जल अपघटन । सामान्यतः रासायनिक बलगतिकी के अन्तर्गत मध्यम वेग से होने वाली अभिक्रियाओं का अध्ययन किया जाता है।
अभिक्रियाओं से सम्बन्धित कुछ प्रमुख शब्द (Some Important Terms Related to Reactions)
अभिक्रियाओं से सम्बन्धित कुछ तकनीकी शब्द इस प्रकार हैं
आबन्ध ऊर्जा (Bond Energy)
गैसीय स्थिति में दो परमाणुओं के बीच विशिष्ट आबन्धों के एक मोल को तोड़ने के लिए आवश्यक ऊर्जा को आबन्ध ऊर्जा कहते हैं। इसे किलोजूल मोल 1 से निरूपित करते हैं।
आबन्ध वियोजन ऊर्जा (bond dissociation energy) जितनी अधिक होगी अणु में आबन्ध उतना ही मजबूत होगा। आबन्ध को तोड़ने में ऊर्जा की आवश्यकता होती है अर्थात् आबन्ध का टूटना ऊष्माशोषी (endothermic) प्रक्रम है और जब आबन्ध बनता है तो ऊष्मा निर्मुक्त होती है, अतः आबन्ध का बनना ऊष्माक्षेपी ( exothermic) प्रक्रम है।

अभिक्रिया वेग की इकाईयाँ (Units of Rate of a Reaction)
अभिक्रिया के वेग की इकाई, सान्द्रता समय-1 है। उदाहरण यदि सान्द्रता की इकाई मोल ली-1 तथा समय की इकाई सेकण्ड में ली जाए तो अभिक्रिया वेग की इकाई मोल ली-1 से-1 होगी। तथापि गैसीय अभिक्रियाओं में जब गैसों की सान्द्रता आंशिक दाब द्वारा व्यक्त की जाती है तब वेग की इकाई वायुमण्डलीय से-1 होगी।
अभिक्रिया वेग को प्रभावित करने वाले कारक (Factors Influencing Rate of a Reaction)
अभिक्रिया का वेग अनेक प्रायोगिक परिस्थितियों पर निर्भर करता है जिनका वर्णन नीचे किया गया है
(i) अभिकारकों की सान्द्रता का प्रभाव (Effect of Concentration of Reactants) किसी दिए गए ताप पर अभिक्रिया वेग, एक अथवा अनेक अभिकारकों तथा उत्पादों की सान्द्रताओं पर निर्भर हो सकता है। सामान्यतः अभिक्रिया वेग अभिकारकों की सान्द्रता में वृद्धि के साथ बढ़ता है, क्योंकि सान्द्रता में वृद्धि से अणुओं के मध्य संघट्टों (collisions) की संख्या बढ़ जाती है।
(ii) ताप (Temperature) सामान्यतः ताप में वृद्धि के साथ अभिक्रिया का वेग बढ़ जाता है। उच्च ताप पर अणुओं की गतिज ऊर्जा उच्च होती है। अतः वेग भी उच्च होता है, जिसके कारण अणुओं के संयुक्त होने की सम्भावना बढ़ जाती हैं।
(iii) अभिकारकों की प्रकृति (Nature of Reactants) किसी अभिक्रिया का वेग अभिकारकों की प्रकृति से भी प्रभावित होता है जैसे सामान्य ताप पर सोडियम और पोटैशियम जल के साथ तीव्रता से अभिक्रिया करते हैं, लेकिन लोहा केवल भाप के साथ अभिक्रिया करता है।
(iv) अभिकारकों का पृष्ठीय क्षेत्रफल (Surface Area of Reactants) अभिकारकों का पृष्ठीय क्षेत्रफल जितना अधिक होता है, अभिक्रिया का वेग भी उतना अधिक होता है, क्योंकि अभिक्रिया के लिए अधिक सतह उपलब्ध होती हैं। ठोसों का पृष्ठीय क्षेत्रफल इनको चूर्ण अवस्था में परिवर्तित करके बढ़ाया जा सकता है। जैसे जिंक के टुकड़े की अपेक्षा जिंक डस्ट (पाउडर) की सल्फ्यूरिक अम्ल के साथ अभिक्रिया तीव्रता से होती है।
(v) प्रकाश की उपस्थिति (Presence of Light) कुछ रासायनिक अभिक्रियाओं का वेग प्रकाश (विकिरण) की उपस्थिति में बढ़ जाता है। जैसे क्लोरोफॉर्म का ऑक्सीकरण प्रकाश की उपस्थिति में होता है।

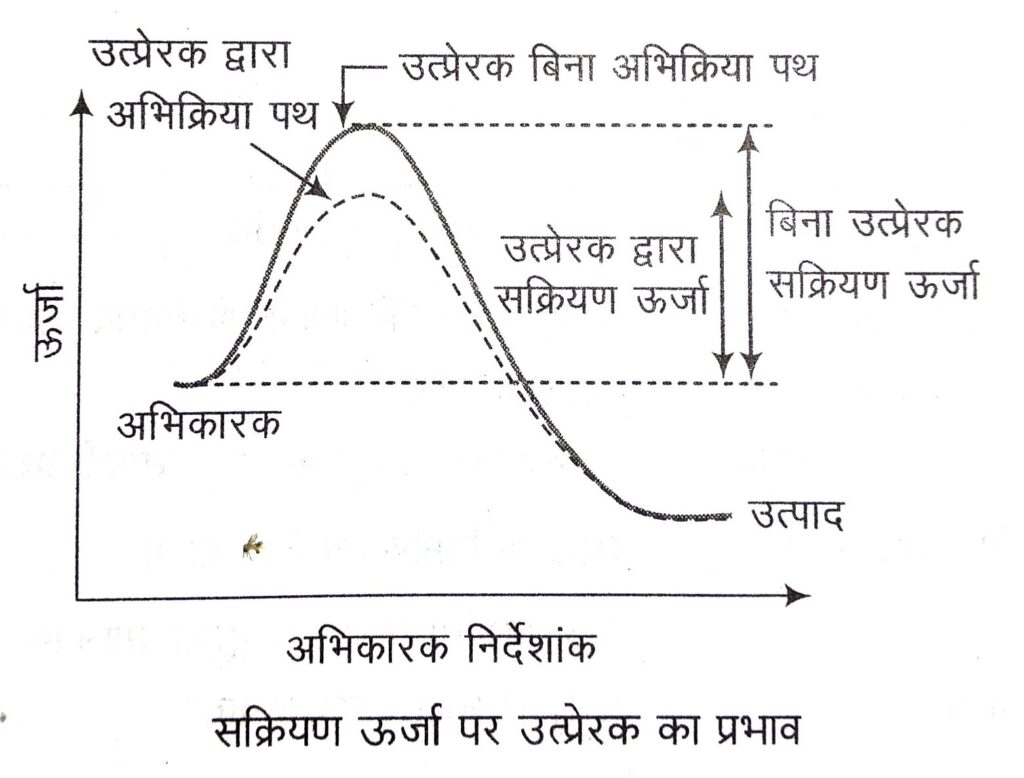
(vi) उत्प्रेरक की उपस्थिति का प्रभाव (Effect of Presence of a Catalyst) उत्प्रेरक की उपस्थिति में अभिक्रिया का वेग बढ़ जाता है। उत्प्रेरक प्रकृति में विशिष्ट है और यह एक वैकल्पिक पथ (alternative path) से अभिकारकों व उत्पादों के मध्य सक्रियण ऊर्जा (alternative path) कम करके अभिक्रिया के वेग को बढ़ाता है।
सक्रियण ऊर्जा (Activation Energy)
रासायनिक अभिक्रिया में भाग लेने से पूर्व अभिकारकों के अणु कुछ अतिरिक्त ऊर्जा का अवशोषण करते हैं और एक-दूसरे के साथ आकर सक्रियत संकुल (activated complex) बनाते हैं। यह सक्रियत संकुल अस्थायी होता है, क्योंकि इसकी स्थितिज ऊर्जा अति उच्च है। अतः यह उत्पादों में अपघटित हो जाता है। अतः सक्रियण ऊर्जा वह अतिरिक्त ऊर्जा है, जो अभिकारक अणुओं को सक्रियत संकुल बनाने के लिए आवश्यक है।
सक्रियण ऊर्जा का मान जितना कम होगा। अभिक्रिया भी उतनी तीव्रता से होगी।
उत्प्रेरण (Catalysis)
वे पदार्थ जो रासायनिक अभिक्रिया के पश्चात् रासायनिक एवं मात्रात्मक रूप में अपरिवर्तित रहते हुए, रासायनिक अभिक्रिया की दर में वृद्धि कर देते हैं उत्प्रेरक कहलाते हैं एवं इस परिघटना को उत्प्रेरण (catalysis) कहते हैं। सर्वप्रथम बर्जीलियस ने 1835 में उत्प्रेरण की परिघटना का निरीक्षण किया था । वास्तव में उत्प्रेरक अपेक्षाकृत कम सक्रियण ऊर्जा वाला नया अभिक्रिया पथ उपलब्ध कराता है, जिससे अधिक-से-अधिक अभिकारक अणु उत्पाद बना सकें।
उत्प्रेरक स्वतः प्रवर्तित (spontaneous) अभिक्रियाओं को उत्प्रेरित करता है, परन्तु स्वतः अप्रवर्तित (non-spontaneous) अभिक्रिया को उत्प्रेरित नहीं करता है।
उत्प्रेरक किसी अभिक्रिया के साम्य स्थिरांक में परिवर्तन नहीं करता है, किन्तु यह साम्य को शीघ्र स्थापित करने में सहायता करता है। यह अग्र और प्रतीप दोनों अभिक्रियाओं को समान रूप से उत्प्रेरित करता है, जिससे साम्यावस्था अपरिवर्तित रहती है परन्तु शीघ्र स्थापित हो जाती है।
वर्धक एवं विषकारक (Promoters and Poisons)
उत्प्रेरक वर्धक उत्प्रेरक की सक्रियता को बढ़ा देते हैं, जबकि विष कारक उत्प्रेरक की सक्रियता को घटा देते हैं। उदाहरण हैबर प्रक्रम द्वारा अमोनिया के निर्माण में मोलिब्डेनम (Mo), आयरन उत्प्रेरक की सक्रियता को बढ़ा देता है और पेट्रोलियम के भंजक में कार्बन सिलिका – ऐलुमिना उत्प्रेरक के लिये विष का कार्य करता है।
उत्प्रेरण के प्रकार (Types of Catalysis)
उत्प्रेरण मुख्यतः दो समूहों में विभाजित किया जा सकता है
1. समांगी उत्प्रेरण (Homogeneous Catalysis)
जब अभिकारक एवं उत्प्रेरक समान प्रावस्था (अर्थात् द्रव या गैस) में हो तो प्रक्रम समांगी उत्प्रेरण कहलाता है।
उदाहरण 
उपरोक्त अभिक्रिया में, अभिकारक, सल्फर डाइऑक्साइड तथा ऑक्सीजन एवं उत्प्रेरक नाइट्रिक ऑक्साइड सभी समान प्रावस्था (गैस प्रावस्था) में हैं।
2. विषमांगी उत्पेरण (Heterogeneous Catalysis)
उत्प्रेरकी प्रक्रम जिसमें अभिकारक एवं उत्प्रेरक भिन्न प्रावस्थाओं में होते हैं, विषमांगी उत्प्रेरण कहलाता है।
उदाहरण 

उपरोक्त अभिक्रिया में अभिकारक गैसीय प्रावस्था में है, जबकि उत्प्रेरक ठोस अवस्था में है।
उत्प्रेरक के प्रकार (Types of Catalyst)
उत्प्रेरक निम्न प्रकार हो सकते हैं
(i) धनात्मक उत्प्रेरक (Positive Catalyst) सक्रियण ऊर्जा घटाकर अभिक्रिया का वेग बढ़ाते हैं।
(ii) ऋणात्मक उत्प्रेरक (Negative Catalyst) सक्रियण ऊर्जा बढ़ाकर अभिक्रिया का वेग घटाते हैं।
(iii) प्रेरित उत्प्रेरक (Induced Catalyst) एक अभिक्रिया का उत्पाद दूसरे के लिए उत्प्रेरक का कार्य करता है।
(iv) स्व: उत्प्रेरक (Autocatalyst) अभिक्रिया का उत्पाद समान अभिक्रिया के लिए उत्प्रेरक का कार्य करता है।
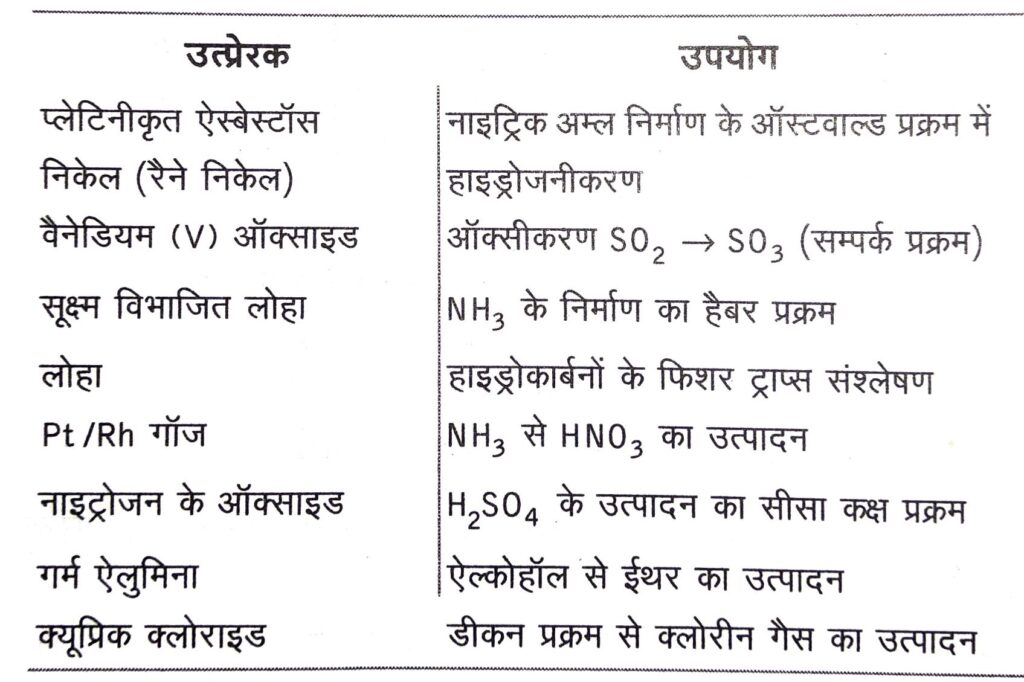
उत्प्रेरक के उपयोग (Uses of Catalysts)
कुछ उत्प्रेरकों के उपयोग नीचे सारणीबद्ध दिए गए हैं
अभिक्रिया की कोटि (Order of a Reaction)
किसी अभिक्रिया की कोटि, सान्द्रताओं, जिन पर वास्तव में अभिक्रिया का वेग निर्भर करता है, जिसका निरीक्षण प्रायोगिक रूप से किया गया हो, का योग है।
अभिक्रिया की कोटि 0, 1, 2, 3 अथवा भिन्नात्मक हो सकती है। अभिक्रिया की कोटि के शून्य होने का अर्थ है, कि अभिक्रिया वेग अभिकारकों की सान्द्रता पर निर्भर नहीं करता।
अभिक्रिया की आण्विकता (Molecularity of a Reaction)
प्राथमिक अभिक्रिया में भाग लेने वाली स्पीशीज (परमाणु, आयन अथवा अणु) जो कि एक साथ संघट्ट के फलस्वरूप रासायनिक अभिक्रिया करती हैं, की संख्या को अभिक्रिया की आण्विकता कहते हैं।

◆ यदि कोई अभिक्रिया एक से अधिक पदों में सम्पन्न होती है, तो अभिक्रिया का कुल वेग अभिक्रिया के सबसे मन्द पद द्वारा नियन्त्रित होता है। सबसे मन्द पद को वेग निर्धारक पद कहते हैं।
◆ अभिक्रिया की कोटि शून्य तथा भिन्नात्मक भी हो सकती है, लेकिन अभिक्रिया की आण्विकता शून्य अथवा अपूर्णांक नहीं हो सकती है।
◆ सबसे मन्द पद की आण्विकता तथा अभिक्रिया (जटिल अभिक्रिया) की कोटि समान होती है।
◆ इक्षु-शर्करा का प्रतिलोमन और एस्टर का जल-अपघटन छद्म प्रथम कोटि अभिक्रिया के उदाहरण हैं। अर्थात् इन अभिक्रियाओं में अभिकारक एक से अधिक होते हैं लेकिन अभिक्रिया का वेग केवल एक अभिकारक की सान्द्रता पर निर्भर करता है।
रासायनिक साम्यावस्था (Chemical Equilibrium)
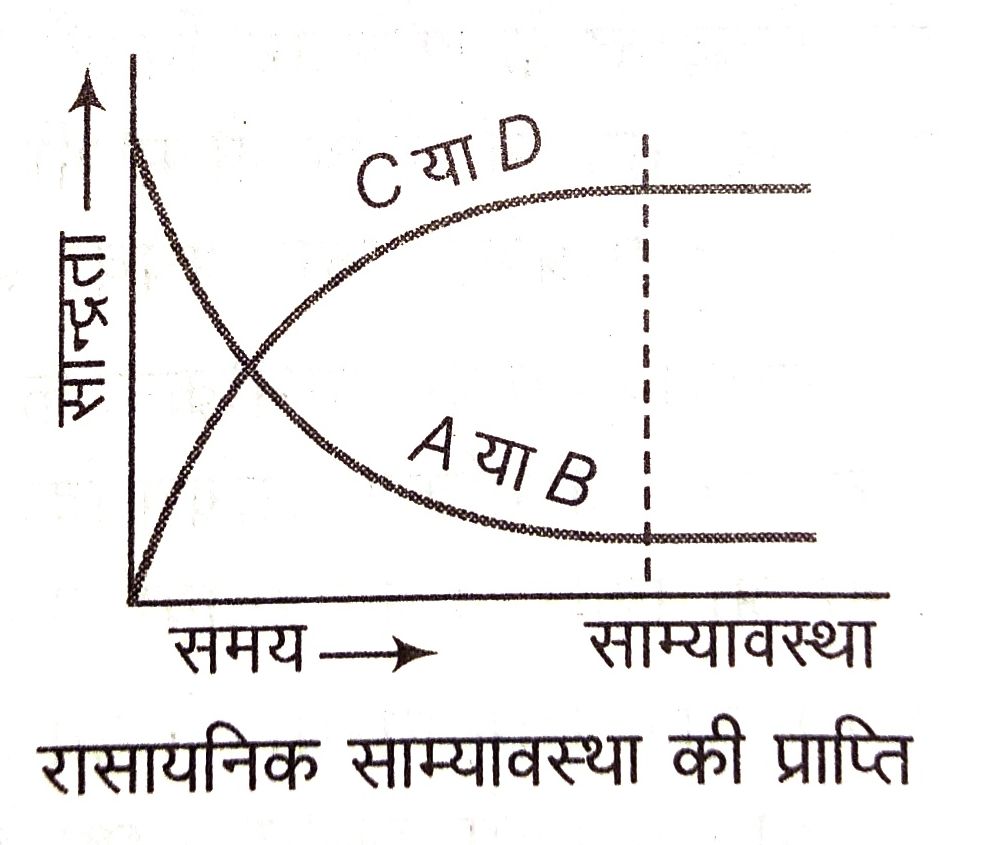
हम एक सामान्य उत्क्रमणीय अभिक्रिया पर विचार करते हैं

समय बीतने के साथ अभिकारकों (A तथा B) की सान्द्रता घटती है तथा उत्पादों ( C तथा D) की सान्द्रता बढ़ती है। अग्र अभिक्रिया की दर घटती जाती है और प्रतीप अभिक्रिया की दर बढ़ती जाती है। कुछ समय पश्चात् एक ऐसी स्थिति आती है कि अग्र अभिक्रिया की दर प्रतीप अभिक्रिया की द के बराबर हो जाता है। इसे रासायनिक साम्यावस्था कहते हैं। यह साम्य गतिक साम्य है अर्थात् कोई भी अभिक्रिया रुकती नहीं है, लेकिन दोनों समान दर से होती रहती है।
रासायनिक साम्यावस्था का नियम तथा साम्यावस्था स्थिरांक (Law of Chemical Equilibrium and Equilibrium Constant)
सी एम गुलबर्ग एवं पीटर वागे ने सन् 1864 में ‘द्रव्य अनुपाती क्रिया का नियम’ प्रतिपादित किया। उन्होंने प्रतिपादित किया कि किसी पदार्थ की रासायनिक अभिक्रिया की दर उस पदार्थ के सक्रिय द्रव्यमान के समानुपाती होती है। अथवा अभिकारकों के रासायनिक अभिक्रिया में भाग लेने की दर अभिकारकों के सक्रिय द्रव्यमानों के गुणनफल के समानुपाती होती है।
किसी रासायनिक अभिक्रिया के लिए,


ला-शातेलिए सिद्धान्त (Le-Chatelier’s Principle)
इस सिद्धान्त के अनुसार, किसी निकाय की साम्यावस्था परिस्थितियों को निर्धारित करने वाले कारकों (सान्द्रण, दाब एवं ताप) में से किसी में भी परिवर्तन होने पर साम्यावस्था उस दिशा में अग्रसर होती है, जिससे निकाय पर लगाया हुआ प्रभाव कम अथवा समाप्त हो जाए
जब साम्यावस्था पर अभिक्रिया के अभिकारकों में से किसी एक की सान्द्रता को बढ़ाया जाता है या उत्पाद को हटाया जाता है तो अभिक्रिया अग्रिम दिशा की ओर अग्रसर होती है। और यदि साम्यावस्था पर उत्पादों को मिलाया जाता है या अभिकारकों को हटाया जाता है तो अभिक्रिया पश्चगामी दिशा में अग्रसर होगी।
ताप में वृद्धि साम्यावस्था को उन अभिक्रियाओं जोकि ऊष्मा के अवशोषण के साथ होती हैं, को अग्रिम दिशा में तथा उन अभिक्रियाओं जो कि ऊष्मा के निर्मुक्त होने के साथ होती हैं, को पश्चगामी दिशा में विस्थापित करती हैं। यदि दाब बढ़ाया जाता है, तो अभिक्रिया उस दिशा में होगी जिसमें दाब में कमी आयेगी।
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here