गैसीय अवस्था (Gaseous State)
गैसीय अवस्था (Gaseous State)
गैसीय अवस्था (Gaseous State)
हम पढ़ चुके हैं कि द्रव्य तीन अवस्थाओं में पाया जाता है (ठोस, द्रव और गैस)। ठोस और द्रवों से भिन्न गैसों में कुछ विशेष गुण होते हैं उदाहरण के लिए,
(i) गैसों को आसानी से सम्पीडित (compressed) किया जा सकता है।
(ii) गैसों का न तो निश्चित आयतन होता है और न ही निश्चित आकृति होती है, गैस पात्र का सम्पूर्ण आयतन घेर लेती है।
गैस के नियम (Gas Laws)
दाब, आयतन, ताप और द्रव्यमान ये चारों गैस के मापनीय गुण हैं। इन चरों के मध्य अन्तः सम्बन्ध गैस नियमों का सूत्रपात करते हैं।



आदर्श गैस (Perfect Gas or Ideal Gas)
गैसें जिनके अणु द्रव्यमान बिन्दु (आयतन बिना द्रव्यमान) हैं तथा जो एक दूसरे को आकर्षित नहीं करते हैं आदर्श गैस कहलाती है। यह काल्पनिक अवधारणा है, जिनका वास्तव में अस्तित्व नहीं है। गैसें जैसे हाइड्रोजन, ऑक्सीजन और हीलियम, जिनका द्रवीकरण नहीं हो सकता है स्थायी गैस (permanent gases) कहलाती हैं।
आदर्श गैस के गुणधर्म निम्न प्रकार हैं
(i) यह ताप और दाब की सभी परिस्थितियों में बॉयल के नियम, चार्ल्स के नियम और आवोगाद्रो के नियम का पूर्णतः पालन करती है।
(ii) इसका दाब गुणांक और आयतन गुणांक दोनों ठीक एक दूसरे के बराबर होते हैं।
(iii) किसी आदर्श गैस को द्रव या ठोस में परिवर्तित नहीं किया जा सकता है, क्योंकि द्रव और ठोस अवस्था में अणुओं के मध्य आकर्षण बल का होना आवश्यक है।
आदर्श गैस समीकरण (Ideal Gas Equation)
तीनों नियमों (बॉयल का नियम, चार्ल्स का नियम और आवोग्रादो नियम) को एक समीकरण के द्वारा जोड़ा जा सकता है। इसे आदर्श गैस समीकरण कहते हैं।

R को गैस नियतांक या सार्वत्रिक गैस नियतांक कहते हैं, इसका मान 8.314 जूल मोल-1 केल्विन-1 या 0.0821 ली मोल-1 केल्विन-1 है। आदर्श गैस समीकरण का सम्बन्ध इन चार चरों से है और यह किसी गैस की अवस्था की व्याख्या करता है। अतः इसे अवस्था समीकरण (equation of state) भी कहते हैं।
वास्तविक गैसें (Real Gases)
वास्तविक गैसें ताप व दाब की विशेष स्थितियों में ही गैस नियमों का पालन करती हैं। अर्थात् ये केवल उच्च ताप और निम्न दाब पर आदर्श व्यवहार दर्शाती हैं। इनका आयतन होता है तथा अन्तराअणुक आकर्षण बल भी होते हैं। कोई भी वास्तविक गैस पूर्णतः आदर्श नहीं होती है।
गैसों का अणुगति सिद्धान्त (Kinetic Theory of Gases)
जे बर्नोली प्रथम वैज्ञानिक थे जिन्होंने 1738 में गैसों के व्यवहार की व्याख्या की। बाद में रूडोल्फ क्लॉजियस और जेम्स क्लार्क मैक्सवेल ने गैसों के गतिज आण्विक सिद्धान्त का विकास किया। इसकी सहायता से गैसों का व्यवहार, लक्षण, प्रकृति और गैस के नियमों की व्याख्या की जा सकती है।
इसकी मुख्य अभिधारणाएँ निम्न प्रकार हैं
(i) प्रत्येक गैस अति सूक्ष्म, विविक्त, समरूप कणों से बनी है, जिन्हें अणु कहते हैं तथा जो पूरे पात्र में फैले होते हैं।
(ii) गैस के अणु इतने छोटे और इतने दूर होते हैं, कि गैस-अणुओं का कुल आयतन उनके मध्य के रिक्त स्थान की तुलना में नगण्य होता है।
(iii) गैस के अणु लगातार तीव्र गति से अनियमित गति करते रहते हैं। ये सीधी रेखा में समान गति से चलते रहते हैं, दूसरे अणुओं से टकराने या पात्र की दीवार से टकराने पर इनकी दिशा परिवर्तित हो जाती है।
(iv) अन्तराअणुक बल नगण्य होते हैं अतः गैस के अणु एक दूसरे से मुक्त स्वछन्दता से गति कर सकते हैं।
(v) गैस के अणुओं के मध्य संघट्ट पूर्णतः प्रत्यास्थ होती है। अतः संघट्ट के दौरान गतिज ऊर्जा की हानि नहीं होती है। यद्यपि संघट्ट में अणुओं के मध्य ऊर्जा का वितरण पुनः हो सकता है।
(vi) संघट्ट के प्रभाव की अपेक्षा अणुओं की गति पर गुरुत्व का प्रभाव नगण्य होता है।
(vii) गैस का दाब उसके अणुओं की पात्र की दीवारों से संघट्टों (टक्करों) के कारण उत्पन्न होता है, संघट्ट के उपरान्त अणु के संवेग में परिवर्तन हो जाता है। संवेग के परिवर्तन की दर दीवारों पर लगाए बल के बराबर होती है (न्यूटन का द्वितीय नियम) ।
क्योंकि बड़ी संख्या में अणु दीवारों से टकराते है अतः वे दीवारों पर बल लगाते हैं, जिसे संवेग में परिवर्तन की औसत दर से दिया जा सकता है।
दीवार के प्रति इकाई क्षेत्रफल पर लगने वाला बल गैस का दाब कहलाता है।
.:. दाब ∝ पात्र की दीवार पर इकाई समय में प्रति इकाई क्षेत्रफल में अणुओं द्वारा किए गए संघट्टों की संख्या ।
(viii) किसी भी समय गैस के दिए गए नमूने में विभिन्न अणुओं की गति भिन्न होती है अतः गतिज ऊर्जाएँ भी भिन्न होती हैं। यद्यपि अणुओं की औसत गतिज ऊर्जा उसके परमताप के समानुपाती होती है। (अणुगति सिद्धान्त में ऐसा माना गया है।)
गतिज ऊर्जा ∝ परमताप
गैस के अणुओं के विभिन्न वेग (Different Speeds of Gas Molecules)
(i) औसत वेग (Average Speed) यह गैस में उपस्थित सभी अणुओं के वेगों के औसत के रूप में परिभाषित किया जाता है। इसे υ से निरूपित किया जाता है।
(ii) अधिकतम प्रायिकता वेग (Most Probable Speed) दिये गये तार पर गैस के उन अणुओं की कुल संख्या का एक अधिकतम भिन्नांक, जो एक नियत वेग की प्रवृत्ति रखते हैं, अधिकतम संभावित वेग कहलाता है। इसे α से निरूपित करते हैं ।
(iii) वर्ग माध्य मूल वेग (Root Mean Square Speed, RMS) गैस के अणुओं की एक बड़ी संख्या के वेगों के वर्गों के औसत के वर्गमूल को वर्ग माध्य मूल वेग (RMS वेग) कहा जाता है। इसे u से निरूपित किया जाता है। ताप में वृद्धि के साथ गैस के अणुओं का RMS वेग बढ़ता है। लेकिन अणुभार में वृद्धि के साथ यह घटता है।

स्वतन्त्रता की कोटि (Degree of Freedom)
स्वतन्त्रता की कोटि किसी निकाय की सम्भव स्वतन्त्र गतियों की संख्या को बताती है अथवा किसी कण की स्थिति व अभिविन्यास को पूर्णतया व्यक्त करने के लिए आवश्यक न्यूनतम निर्देशांकों की संख्या को स्वतन्त्रता की कोटि कहते हैं। इसे N से प्रदर्शित करते हैं ।
स्वतन्त्रता की कोटि N = 3A – R
जहाँ, A = निकाय में उपस्थित कणों की संख्या
R = स्वतन्त्र प्रतिबन्धों की संख्या
गैस अणुओं की स्वतन्त्रता की कोटि (Degree of Freedom of Gas Molecules)
गैस अणुओं में निम्नलिखित प्रकार की ऊर्जा होती है
(i) स्थानान्तरीय गतिज ऊर्जा
(ii) घूर्णन गतिज ऊर्जा
(iii) कम्पनिक ऊर्जा (स्थितिज + गतिज)
तीनों प्रकार की ऊर्जाओं के आधार पर गैस अणुओं की स्वतन्त्रता की कोटि स्थानान्तरीय और घूर्णन/कम्पनीय हो सकती है।
अतः स्वतन्त्रता की कोटि की संख्या
◆ एकपरमाणुक गैस (He) के लिए = 3
◆ द्विपरमाणुक गैस (O2, CO2 तथा H2 ) के लिए = 5
◆ त्रिपरमाणुक अरेखीय गैस (NH3) के लिए = 6
निम्नलिखित चित्रों पर विचार कीजिए
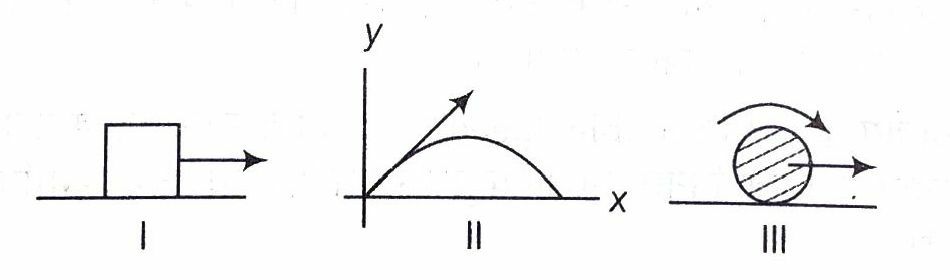
(a) चित्र I में, गुटके की स्वतन्त्रता की कोटि एक है क्योंकि यह केवल सीधी रेखा में गति कर सकता है तथा केवल एक स्थानान्तरीय स्वतन्त्रता की कोटि से सम्बन्धित है।
(b) चित्र II में, प्रक्षेप्य की स्वतन्त्रता की कोटि दो है क्योंकि यह एक तल में गति करता है। अतः दो स्थानान्तरीय स्वतन्त्रता की कोटियों से सम्बन्धित है।
(c) चित्र III में, ठोस गोला की स्वतन्त्रता की कोटि दो है जिनमें से एक घूर्णन तथा एक स्थानान्तरीय है।
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here