विलयन और कोलॉइड (Solutions and Colloids)
विलयन और कोलॉइड (Solutions and Colloids)
विलयन और कोलॉइड (Solutions and Colloids)
हमारे दैनिक जीवन में हम बहुत कम शुद्ध पदार्थों से परिचित होते हैं। इनमें से अधिकांश दो या दो से अधिक शुद्ध पदार्थों से बने मिश्रण होते हैं। इन मिश्रणों को विलयन भी कहते हैं। अपने संघटन के आधार पर (अवयव के कणीय आकार), इन्हें विलयन (solution), निलम्बन (suspension) तथा कोलॉइड (colloids) में वर्गीकृत किया गया है। जीवन में इनकी उपयोगिता या महत्त्व इनके संघटन पर निर्भर करती है।
विलयन या वास्तविक विलयन (Solution or True Solution)
विलयन दो या दो से अधिक पदार्थों का समांगी (homogeneous) मिश्रण है जिसमें नियत ताप पर अवयवों की सम्बन्धित मात्राओं में एक निश्चित सीमा तक परिवर्तन किया जा सकता है।
नींबू पानी, सोडा पानी, आदि हमारे दैनिक जीवन में विलयनों के उदाहरण हैं।
विलयन के अवयव (Components of a Solution)
किसी द्विअंगी विलयन (दो पदार्थों का मिश्रण) में दो अवयव होते हैं : विलेय तथा विलायक |
(i) विलायक (Solvent) विलयन का वह अवयव जो अपेक्षाकृत अधिक मात्रा में होता है, विलायक कहलाता है। जिस विलायक का डाइइलेक्ट्रिक नियतांक जितना अधिक होता है, वह उतना अच्छा विलायक होता है। जल का डाइइलेक्ट्रिक नियतांक अधिक (80) है। अतः इसे सार्वत्रिक विलायक (universal solvent) कहते हैं।
विलायकों का उपयोग इत्र (perfumes) निर्माण में, औषधि निर्माण में, रंग रोगन घोलने में, निर्जल धुलाई (dry cleaning) में, अनेक प्रकार के खाद्य पदार्थ और पेयों में किया जाता है।
(ii) विलेय (Solute) विलयन में विलायक के अतिरिक्त उपस्थित एक या अधिक अवयव विलेय कहलाते हैं। सामान्यतयः द्विअंगी विलयन में विलेय की मात्रा विलायक से कम होती है। उदाहरण आयोडीन और ऐल्कोहॉल का विलयन जिसे टिक्चर आयोडीन के नाम से जाना जाता है, इसमें आयोडीन विलेय है और ऐल्कोहॉल विलायक है। वात युक्त पेय (aerated drinks) जैसे सोडा जल, कोक, आदि में CO2 विलेय है और जल विलायक ।
विलयन के गुणधर्म (Properties of a Solution)
(i) विलयन एक समांगी मिश्रण है। अर्थात् मिश्रण में सभी जगह इसका संघटन व गुण एक समान होते हैं।
(ii) विलयन के कण व्यास में 1 नैनोमी (10-9 मी) से भी छोटे होते हैं। इसलिए ये आँख से नहीं देखे जा सकते हैं।
(iii) अपने छोटे आकार के कारण विलयन के कण, गुजर रही प्रकाश की किरण को फैलाते नहीं हैं इसलिए विलयन में प्रकाश का मार्ग दिखाई नहीं देता है। दूसरे शब्दों में, विलयन टिण्डल प्रभाव (Tyndall effect) नहीं दर्शाते हैं।
(iv) विलयन के अवयव (विलेय तथा विलायक) एक दूसरे में इस प्रकार विसरित (घुल-मिल) हो जाते हैं कि एक का दूसरे से विभेद करना सम्भव नहीं होता है।
(v) छानने (filteration) की विधि द्वारा विलेय के कणों को विलयन में से पृथक् नहीं किया जा सकता है, क्योंकि विलेय के कणों का आकार बहुत छोटा होता है। विलयन को शान्त छोड़ देने पर भी विलेय के कण नीचे नहीं बैठते हैं, अर्थात् विलयन स्थायी एवं पारदर्शक (transparent) होता है।
विलयनों के प्रकार (Types of Solutions)
I. दिए गए विलायक में विलेय की मात्रा के आधार पर विलयनों को निम्न प्रकार वर्गीकृत किया गया है
(i) असंतृप्त विलयन ( Unsaturated Solution ) वह विलयन जिसमें ताप वृद्धि किए बिना और अधिक विलेय घोला जा सके, असंतृप्त विलयन कहलाता है।
(ii) संतृप्त विलयन (Saturated Solution ) वह विलयन जिसमें दिए गए ताप एवं दाब पर और अधिक विलेय (solute) नहीं घोला जा सके, संतृप्त विलयन कहलाता है।
(iii) अतिसंतृप्त विलयन (Supersaturated Solution) जब संतृप्त विलयन को गर्म किया जाता है, तो विलेय पदार्थ को घोलने की इसकी क्षमता बढ़ जाती है। इसे अतिसंतृप्त विलयन कहते हैं। अतिसंतृप्त विलयन में दिए गए ताप पर विलेय पदार्थ की मात्रा विलयन की क्षमता से अधिक घुली होती है। यदि इस विलयन में एक छोटा क्रिस्टल विलेय का डाल दिया जाए, तो विलेय की अधिक घुली मात्रा का शीघ्रता से क्रिस्टलीकरण (crystallisation) हो जाता है।
II. विलेय और विलायक की अवस्थाओं के आधार पर विलयनों को निम्न प्रकार वर्गीकृत किया गया है
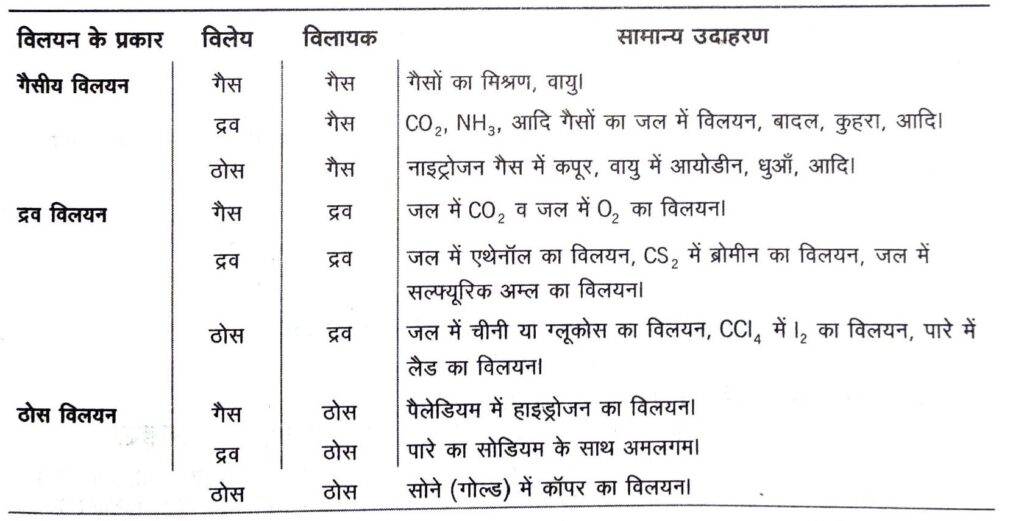
जलीय विलयन (Aqueous Solutions) जब विलेय जल में घुला हो, तो इसे जलीय विलयन कहते हैं। उदाहरण जल में एथिल ऐल्कोहॉल।
अजलीय विलयन (Non-Aqueous Solutions) जब विलेय जल को छोड़कर अन्य विलायक में घुला हो, तो इसे अजलीय विलयन कहते हैं।
उदाहरण ऐल्कोहॉल में आयोडीन (टिंक्चर आयोडीन ) ।
उदासीन विलयन (Neutral Solutions) इन विलयनों में H+ आयनों (हाइड्रोजन आयनों) तथा OH– आयनों (हाइड्रॉक्सिल आयनों) की सान्द्रताएँ समान होती हैं।
अम्लीय तथा क्षारीय विलयन (Acidic and Basic Solutions) अम्लीय विलयनों में OH– आयनों की तुलना में अधिक H+ आयन होते हैं, जबकि क्षारीय विलयनों में H+ आयनों की तुलना में OH– आयन अधिक होते हैं।
विलयन की सान्द्रता (Concentration of a Solution)
विलेय पदार्थ की मात्रा जो विलयन के किसी दी गई मात्रा अथवा आयतन में उपस्थित हो उसे विलयन की सान्द्रता कहते हैं। अपेक्षाकृत कम सान्द्रता वाले विलयनों को तनु विलयन (dilute solutions) तथा अधिक सान्द्रता वाले विलयनों को सान्द्र विलयन (concentrated solutions) कहते हैं।
विलयन की सान्द्रता को व्यक्त करना (Expressing the Concentration of a Solution)

किसी विलायक में विलेय की विलेयता को प्रभावित करने वाले कारक (Factors Affecting Solubility of a Solute in a Solvent)
(i) विलेय तथा विलायक की प्रकृति (Nature of Solute and Solvent) (समान-समान को घोलता है) ध्रुवीय विलेय जैसे सोडियम क्लोराइड ध्रुवीय विलायक जैसे जल में घुलते हैं। इसी प्रकार अध्रुवीय विलेय जैसे कोलेस्टरॉल, ब्रोमीन, आदि अध्रुवीय विलायक जैसे बेंजीन, कार्बन टेट्राक्लोराइड (CCI4) आदि में घुलते हैं।
(ii) ताप का प्रभाव (Effect of Temperature) सामान्यतः विलयन का ताप बढ़ने पर विलेय की विलेयता बढ़ जाती है। अर्थात् विलयन में घुलने की प्रक्रिया ऊष्माशोषी (endothermic) है (ऊर्जा का अवशोषण होता है)। लेकिन कुछ पदार्थों जैसे कैल्सियम नाइट्रेट, कैल्सियम ऑक्साइड, सोडियम सल्फेट, कैल्सियम हाइड्रॉक्साइड और कैल्सियम सिट्रेट की विलेयता ताप बढ़ने के साथ घटती है, क्योंकि इनके विलयन में घुलने की प्रक्रिया ऊष्माक्षेपी ( exothermic) है और इसमें ऊष्मा मुक्त होती है। द्रव में गैस की विलेयता ताप बढ़ने के साथ घटती है।
(iii) दाब का प्रभाव (Effect of Pressure) ठोसों की द्रवों में विलेयता पर दाब का कोई सार्थक प्रभाव नहीं होता लेकिन दाब बढ़ने में गैसों की द्रव में विलेयता बढ़ जाती है।
(iv) पदार्थ का आकार (Size of Substance) पदार्थ का आण्विक द्रव्यमान बढ़ने के साथ विलेयता घटती है।
कोलॉइडी विलयन (Colloidal Solution)
कोलॉइडी विलयन एक विषमांगी (heterogeneous) निकाय है। यह दो प्रावस्थाओं से बना होता है; परिक्षिप्त प्रावस्था (dispersed phase) (जैसे विलेय) तथा परिक्षेपण माध्यम (dispersion medium) (जैसे विलायक) । पदार्थ जो कि कोलॉइडी कणों के रूप में परिक्षिप्त होता है परिक्षिप्त प्रावस्था कहलाता है तथा कोलॉइडी कण जिस प्रावस्था में परिक्षिप्त होते हैं वह परिक्षेपण माध्यम कहलाता है।
इन कोलॉइडी कणों का आकार 1 नैनोमी से 100 नैनोमी के बीच होता है।
दूध, चेहरे पर लगाने वाली क्रीम, स्पंज, रबड़, प्यूमिस (झाँवा पत्थर), रूधिर, रंगीन काँच एवं रत्न, आदि कोलॉइड के उदाहरण हैं।
◆ जब किसी विलयन के एक अवयव के कण दूसरे में फैले होते हैं, तो इसे परिक्षेपण (dispersion) कहते हैं।
कोलॉइडों का वर्गीकरण (Classification of Colloids)
I. परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्था के आधार पर कोलॉइडों को निम्न प्रकार वर्गीकृत किया गया है
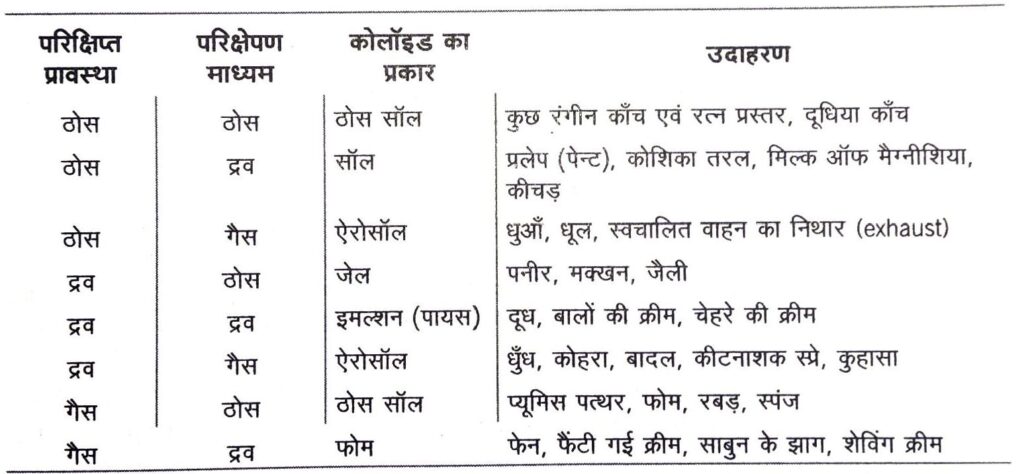
II. परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य पारस्परिक क्रिया की प्रकृति के आधार पर कोलॉइडी विलयनों को दो वर्गों में विभाजित किया गया है

◆ इन कोलॉइडों में यदि परिक्षेपण माध्यम जल है तब ये जलरागी (hydrophilic) और जलविरोधी (hydrophobic) कोलॉइड कहलाते हैं।
◆ स्वर्ण संख्या का प्रयोग कोलॉइडी रसायन में द्रवविरागी कोलॉइड के रक्षण के लिए किया जाता है। यह द्रवरागी कोलॉइड की मिलीग्राम में वह निम्नतम मात्रा है जो 10 मिली स्वर्ण कोलॉइड में उपस्थित होने पर उसका 1 मिली 10% NaCl विलयन द्वारा स्कन्दन होने से रोकती है।
III. परिक्षिप्त प्रावस्था (dispersed phase) के कणों के प्रकार के आधार कोलॉइडों को तीन वर्गों में विभाजित किया गया है
(i) बहुआण्विक कोलॉइड ( multimolecular colloids) बहुत से परमाणु या लघु अणु एकत्रित होकर पुँज बनाते हैं। उदाहरण गोल्ड सॉल, सल्फर सॉल, आदि ।
(ii) वृहदाण्विक कोलॉइड (macromolecular colloids) वृहदाणु कोलॉइडी कणों के आकार की सीमा में टूट जाते हैं। उदाहरण स्टार्च, सेलुलोस, प्रोटीन और एन्जाइम के कोलॉइडी विलयन ।
(iii) सहचारी कोलॉइड या मिसेल ( associated colloids or micelles) केवल विशेष ताप जिसे क्राफ्ट ताप कहते हैं और विशेष सान्द्रता जिसे क्रान्तिक मिसेल सान्द्रता (critical micelle concentration) कहते हैं पर बनते हैं। ये पदार्थ कम सान्द्रताओं पर प्रबल विद्युत अपघट्य की तरह कार्य करते हैं। उदाहरण जल में साबुन का विलयन (मिसेल) [विशेष ताप और विशेष सान्द्रता पर |
◆ साबुन तथा अपमार्जकों की शोधन क्रिया मिसेल निर्माण तथा पायसीकरण (emulsification) के कारण है।
कोलॉइडी विलयनों के गुण (Properties of Colloidal Solutions)
(i) यह एक विषमांगी स्थायी निकाय (heterogeneous permanent system) है जिसे सामान्य निस्यन्दक पत्र (ordinary filter paper) द्वारा छाना नहीं जा सकता है। परिक्षिप्त (dispersed) कणों को आँखों से नहीं देखा जा सकता है लेकिन अतिसूक्ष्मदर्शी द्वारा इन्हें देखा जा सकता है।
(ii) जब प्रकाश को कोलॉइडी सॉल से गुजारते हैं, तो कोलॉइडी कण प्रकाश को फैलाते हैं, जिससे प्रकाश का पथ प्रदीप्त होता है। यह टिण्डल प्रभाव कहलाता है।
टिण्डल प्रभाव (Tyndall Effect)
जब एक कमरे में छोटे छिद्र द्वारा प्रकाश की किरण आती है तब हम टिण्डल प्रभाव देख सकते हैं। जब एक घने जंगल के आच्छादन (canopy) से सूर्य की किरण गुजरती है, तो भी हम वहाँ टिण्डल प्रभाव देख सकते हैं। आकाश और समुद्र के जल का नीला रंग, पुच्छल तारे की पूँछ की दृश्यता, तारों का जगमगाना, प्रकाश के स्रोत में धुएँ का नीलापन, अस्त होते सूर्य का लाल रंग, इन सभी का कारण टिण्डल प्रभाव है।
(iii) कोलॉइडी कणों का लगातार टेढ़ी-मेढ़ी गति करना ब्राउनी गति कहलाता है ( सर्वप्रथम ब्रिटिश वनस्पति वैज्ञानिक रॉबर्ट ब्राउन ने प्रेक्षित की)। यह गति कोलॉइड की प्रकृति से स्वतन्त्र होती है परन्तु कणों के आकार एवं विलयन की श्यानता (viscosity) पर निर्भर करती है। जितना छोटा आकार होगा एवं श्यानता जितनी कम होगी, गति उतनी ही तीव्र होगी।
ब्राउनी गति विलोडन प्रभाव (stirring effect) है, जो सॉल के स्थायित्व के लिए उत्तरदायी होता है। निलम्बन (suspension) तथा वास्तविक विलयन ब्राउनी गति नहीं दर्शाते हैं।
(iv) कोलॉइडी कणों पर हमेशा विद्युत आवेश रहता है। उदाहरण हीमोग्लोबिन (रक्त) धनात्मक आवेशित सॉल है जबकि स्टार्च, गोंद, जिलेटिन, मृत्तिका, चारकोल, आदि के सॉल ऋणात्मक आवेशित हैं।
(v) कोलॉइडी विलयनों का रंग प्रकाश के प्रकीर्णन के कारण होता है। कोलॉडडी विलयन का रंग परिक्षिप्त कणों के द्वारा प्रकीर्णित प्रकाश के तरंगदैर्ध्य पर निर्भर करता है।
(vi) विद्युत अपघट्य की थोड़ी सी मात्रा मिलाकर कोलॉइड के अपक्षेपण करने की प्रक्रिया को स्कन्दन (coagulation) कहते हैं। इस प्रक्रिया में कोलॉइडी कण अपने से विपरीत आवेश वाले आयनों अन्योन्यक्रिया करते हैं, जिससे उदासीनीकरण होता है और स्कन्दन हो जाता है। हल्के जख्मों पर फिटकरी या फैरिक क्लोराइड लगाने पर खून का थक्का बनने से रक्त स्राव रुक जाता है।
पायस (Emulsions )
ये द्रव, द्रव कोलॉइडी निकाय हैं इनमें सूक्ष्म विभाजित द्रव की बूँदों का दूसरे द्रव में परिक्षेपण होता है। जब दो अमिश्रणीय या आंशिक मिश्रणीय द्रवों के मिश्रण को हिलाया जाता है, तो पायस प्राप्त होता है। इनके स्थायित्व के लिए पायसीकर्मक (emulsifying agent or emulsifiers) मिलाया जाता है। प्रोटीन, गोंद, प्राकृतिक एवं संश्लेषित साबुन, ऐल्कोहॉल, आदि प्रमुख पायसीकर्मक हैं।
पायस (इमल्शन) के प्रकार (Types of Emulsions)
ये दो प्रकार के होते हैं। तेल का जल में परिक्षेपण (o/w प्रकार) तथा जल का तेल में परिक्षेपण (w/o प्रकार)। तेल का जल में परिक्षेपण के उदाहरण हैं दूध एवं वेनीशिंग क्रीम। दूध में द्रव वसा जल में परिक्षिप्त होती है। मक्खन एवं क्रीम जल का तेल में परिक्षेपण का उदाहरण है।
पायस के गुणधर्म (Properties of Emulsions)
(i) यह सूक्ष्म विभाजित द्रव की बूँदों का दूसरे द्रव में परिक्षेपण है।
(ii) यह ब्राउनी गति और टिण्डल प्रभाव भी दर्शाता है।
(iii) इन्हें गर्म, ठण्डा या अपकेन्द्रण करके अवयवी द्रवों में तोड़ा जा सकता है।
निलम्बन (Suspension)
निलम्बन एक विषमाँगी (heterogeneous) मिश्रण है, जिसमें विलेय पदार्थ के कण घुलते नहीं है बल्कि माध्यम की समष्टि (bulk) में निलम्बित रहते हैं। जल में चॉक, नदी का प्रदूषित जल, वायु में धुआँ, गन्दा जल, आदि निलम्बन के उदाहरण हैं।
निलम्बन के गुणधर्म (Properties of Suspension)
(i) यह एक विषमांगी मिश्रण है।
(ii) निलम्बन के कण आँखों से देखे जा सकते हैं। इनका आकार 10-5 सेमी या इससे अधिक होता है।
(iii) निलम्बन के कण प्रकाश की किरण को फैला देते हैं, जिससे उसका मार्ग दृष्टिगोचर हो जाता है।
(iv) निलम्बन को शान्त छोड़ने पर निलम्बित कण नीचे बैठ जाते हैं। अतः यह अस्थायी है। छानन विधि द्वारा मिश्रण में से निलम्बित कणों को पृथक् किया जा सकता है। कणों के बैठने से निलम्बन टूट जाता है तथा अब यह प्रकाश की किरणों को नहीं फैलाता है।
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here