अम्ल, क्षारक एवं लवण (Acids, Bases and Salts)
अम्ल, क्षारक एवं लवण (Acids, Bases and Salts)
अम्ल, क्षारक एवं लवण (Acids, Bases and Salts)
सभी यौगिकों को उनके रासायनिक गुणों के आधार पर अम्ल, क्षारक और लवण में वर्गीकृत किया जा सकता है। इनमें कुछ विशिष्ट गुण होते हैं जो एक यौगिक को दूसरे से अलग करते हैं। भोजन का खट्टा या कड़वा स्वाद इनमें उपस्थित अम्ल या क्षारक (क्रमश:) के कारण होता है।
अम्ल (Acids)
एसिड शब्द की उत्पत्ति लैटिन शब्द ‘एसिडस’ (acidus) से हुई है, जिसका अर्थ है ‘खट्टा’ । अतः अम्न वे पदार्थ हैं जिनका स्वाद खट्टा होता है, एक या अधिक विस्थापनशील हाइड्रोजन परमाणु रखते हों और जिनके जलीय विलयन नीले लिटमस को लाल तथा मेथिल ऑरेंज को लाल करते हों ।
उदाहरण हाइड्रोक्लोरिक अम्ल (HCI), नाइट्रिक अम्ल (HNO3), सल्फ्यूरिक अम्ल (H2SO4). आदि।
अम्लों के प्रकार (Types of Acids)
अम्लों को निम्नलिखित समूहों में वर्गीकृत किया गया है
(i) अकार्बनिक अम्ल या खनिज अम्ल (Inorganic or Mineral Acids) अकार्बनिक अम्लों को खनिजों से प्राप्त किया जाता है। उदाहरण हाइड्रोक्लोरिक अम्ल (HCl), नाइट्रिक अम्ल (HNO3), सल्फ्यूरिक अम्ल (H2SO4), आदि।
(ii) कार्बनिक अम्ल (Organic Acids) ये पौधों व जन्तुओं से प्राप्त किए जाते हैं। ये दुर्बल अम्ल हैं। उदाहरण ऑक्सेलिक अम्ल, लैक्टिक अम्ल, यूरिक अम्ल, ऐसीटिक अम्ल, आदि।
(iii) हाइड्रा अम्ल (Hydra Acids) जिन अम्लों में केवल हाइड्रोजन पाया जाता है उन्हें हाइड्रा अम्ल कहते हैं। उदाहरण हाइड्रोफ्लोरिक अम्ल (HF), हाइड्रोक्लोरिक अम्ल (HCl), हाइड्रोसायनिक अम्ल (HCN), आदि।
(iv) ऑक्सी अम्ल ( Oxy Acids) जिन अम्लों में हाइड्रोजन तथा ऑक्सीजन दोनों पाए जाते हैं उन्हें ऑक्सी अम्ल कहते हैं। उदाहरण सल्फ्यूरिक अम्ल (H2SO4), फॉस्फोरिक अम्ल (H3PO4), आदि ।
(v) प्रबल अम्ल (Strong Acids) ये अपने जलीय विलयन में पूर्णतया आयनित हो जाते हैं।
उदाहरण हाइड्रोक्लोरिक अम्ल (HCI), नाइट्रिक अम्ल (HNO3), सल्फ्यूरिक अम्ल (H2SO4) आदि।
(vi) दुर्बल अम्ल (Weak Acids) ये अपने जलीय विलयन में आंशिक रूप से आयनित होते हैं। अतः इनके जलीय विलयन में आयन तथा अणु दोनों उपस्थित होते हैं।
उदाहरण ऐसीटिक अम्ल (CH3 COOH), फॉस्फोरिक अम्ल (H3PO4), कार्बोनिक अम्ल (H2CO3), आदि।
(vii) तनु अम्ल (Dilute Acids) इनके जलीय विलयन में अम्ल की सान्द्रता (मात्रा) अपेक्षाकृत कम होती है।
(viii) सान्द्र अम्ल (Concentrated Acids) इनके जलीय विलयन में अम्ल की सान्द्रता (मात्रा) अपेक्षाकृत अधिक होती है।
अम्लों के गुणधर्म (Properties of Acids)
(i) अम्ल धातु से अभिक्रिया करके हाइड्रोजन गैस तथा धातु के संगत लवण का निर्माण करते हैं।
अम्ल + धातु → लवण + हाइड्रोजन गैस
(ii) अम्ल सभी धातु कार्बोनेट तथा धातु हाइड्रोजन कार्बोनेट के साथ अभिक्रिया करके संगत लवण, कार्बन डाइऑक्साइड एवं जल बनाते हैं।
धातु कार्बोनेट / धातु हाइड्रोजन कार्बोनेट + अम्ल → लवण + कार्बन डाइऑक्साइड + जल
(iii) अम्ल और क्षारक की परस्पर अभिक्रिया के परिणामस्वरूप लवण तथा जल प्राप्त होते हैं। इसे उदासीनीकरण अभिक्रिया (neutralisation reaction) कहते हैं।
अम्ल + क्षारक → लवण + जल
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O
हाइड्रोक्लोरिक अम्ल सोडियम हाइड्रॉक्साइड सोडियम क्लोराइड
(iv) अम्ल, धात्विक ऑक्साइडों के साथ अभिक्रिया करके लवण तथा जल प्रदान करते हैं।
धातु ऑक्साइड + अम्ल → लवण + जल
क्षारक और अम्ल की अभिक्रिया के समान धात्विक ऑक्साइड अम्लों से अभिक्रिया करके लवण और जल देते हैं। अतः धात्विक ऑक्साइड को क्षारकीय ऑक्साइड भी कहते हैं।
(v) अम्ल नाइट्राइट से भूरे रंग की NO2, सल्फाइड से H2S तथा सल्फाइट से SO2 मुक्त करते हैं।
(vi) अम्ल जैसे HCl, HNO3 और H2SO4 अपने जलीय विलयन में विद्युत के अच्छे चालक हैं।
(vii) अम्ल जल में घोले जाने पर H+ (aq) ( हाइड्रोजन आयन) या H3O+ (aq) (हाइड्रोनियम आयन) देते हैं।
उदाहरण HCl + H2O → H3O+ (aq) + Cl– (aq)
विलयन में H+ (aq) आयनों के कारण ही पदार्थ की प्रकृति अम्लीय होती है। जल की अनुपस्थिति में अम्ल के अणुओं में से H+ आयनों को पृथक् करना सम्भव नहीं है अर्थात् H+ आयन अकेले प्राप्त नहीं हो सकते हैं, ये जल के अणुओं से संयुक्त होने के पश्चात् ही मिलते हैं।
H+ + H2O → H3O+
◆ कार्बोक्सिलिक अम्ल, ऐल्कोहॉल से अभिक्रिया करके मीठी गन्धयुक्त यौगिक एस्टर बनाते हैं। यह अभिक्रिया ऐस्टरीकरण (estrification) कहलाती है।
कार्बोक्सिलिक अम्ल + ऐल्कोहॉल → एस्टर + जल

अम्लों के उपयोग (Uses of Acids)
(i) ऐसीटिक अम्ल (Acetic Acid) (CH3 COOH) इसका उपयोग सिरका निर्माण में खाद्य पदार्थों के प्रसंस्करण (food processing) में विलायक के रूप में तथा ऐसीटोन बनाने में किया जाता है।
(ii) बेन्जोइक अम्ल (Benzoic Acid) (C6H5 COOH) इसका उपयोग खाद्य पदार्थों के संरक्षण में किया जाता है।
(iii) सिट्रिक अम्ल (Citric Acid) (C6H8O7) इसका उपयोग खाद्य पदार्थों, दवाओं, धातुओं को साफ करने तथा कपड़ा उद्योग में किया जाता है।
(iv) फॉमिक अम्ल (Formic Acid) (HCOOH) इसका उपयोग फलों के संरक्षण में, रबड़ के स्कन्दन में, जीवाणुनाशक के रूप में, चमड़ा उद्योग में किया जाता है।
(v) हाइड्रोक्लोरिक अम्ल (Hydrochloric Acid) (HCI) इसका उपयोग प्लास्टिक (PVC), रंजक, टेक्सटाईल, औषधियाँ, सौन्दर्य प्रसाधन, एक्वा-रेजिया, आदि के निर्माण में किया जाता है। यह चमड़ा उद्योग में और प्रयोगशाला अभिकर्मक के रूप में भी प्रयुक्त किया जाता है।
(vi) नाइट्रिक अम्ल (Nitric Acid) (HNO3) इसका उपयोग उर्वरकों, रंजकों, प्लास्टिक, दवाओं, एक्वा – रेजिया, विस्फोटकों के निर्माण में, स्टेनलैस स्टील के अम्लोपचार में, धातुओं के निक्षारण में, फोटोग्राफी तथा रॉकेट ईंधनों में किया जाता है।
(vii) सल्फ्यूरिक अम्ल (Sulphuric Acid) (H2SO4) इसका उपयोग पेट्रोलियम के शोधन में, वर्णकों, प्रलेपों, रंजकों के, मध्यवर्तियों के उत्पादन में, अपमार्जक उद्योग में, धातुकर्मीय प्रक्रमों में संचायक बैटरियों में, नाइट्रोसेलुलोस के उत्पादन में किया जाता है। इसका उपयोग पेट्रोलियम के अन्वेषण में भी किया जाता है।
(viii) ऑक्सेलिक अम्ल (Oxalic Acid) (H2C2O4) इसका उपयोग फोटोग्राफी में, कपड़ों की रंगाई और छपाई में, चमड़े के विरंजन में, कपड़ों से स्याही और जंग के दाग हटाने में किया जाता है।
क्षारक (Bases)
क्षारक वे पदार्थ हैं, जिनका स्वाद कड़वा होता है। ये स्पर्श में साबुन जैसे चिकने होते हैं। ये लाल लिटमस विलयन को नीला तथा मेथिल ऑरेंज को पीला तथा फिनॉल्फ्थैलीन को गुलाबी कर देते हैं। उदाहरण पोटैशियम हाइड्रॉक्साइड (KOH), मैग्नीशियम हाइड्रॉक्साइड [Mg (OH)2] और सोडियम हाइड्रॉक्साइड (NaOH), आदि। रासायनिक भाषा में क्षारक वे धात्विक यौगिक या मूलक हैं जो अम्ल से अभिक्रिया करते हैं और उन्हें उदासीन करते हैं। सामान्यता, धात्विक ऑक्साइड और हाइड्रॉक्साइड क्षारकों की तरह व्यवहार करते हैं।
क्षारकों के प्रकार (Types of Bases)
आयनीकरण की मात्रा के आधार पर
(i) प्रबल क्षारक (Strong Bases) ये अपने जलीय विलयन में पूर्णतया आयनित हो जाते हैं। उदाहरण सोडियम हाइड्रॉक्साइड (NaOH), पोटैशियम हाइड्रॉक्साइड (KOH), बेरियम हाइड्रॉक्साइड (Ba(OH)2), आदि।
सामान्यता क्षार धातुओं और क्षारीय मृदा धातुओं के ऑक्साइड और हाइड्रॉक्साइड प्रबल क्षारक है।
(ii) दुर्बल क्षारक (Weak Bases) ये अपने जलीय विलयन में आंशिक रूप से आयनित होते हैं अतः इनके जलीय विलयन में अणु तथा आयन दोनों होते हैं। उदाहरण अमोनियम हाइड्रॉक्साइड (NH4OH), आयरन हाइड्रॉक्साइड (Fe(OH)2), मैग्नीशियम हाइड्रॉक्साइड (Mg (OH)2), आदि।
क्षारकों के गुणधर्म (Properties of Bases)
(i) क्षारक धातु से अभिक्रिया करके हाइड्रोजन गैस के उत्सर्जन के साथ लवण का निर्माण करते हैं।
2NaOH + Zn → Na2ZnO2 + H2 ↑
सोडियम हाइड्रॉक्साइड सोडियम जिंकेट
यद्यपि सभी क्षार धातुओं के साथ इस प्रकार की अभिक्रियाएँ नहीं देते हैं।
(ii) क्षारकों की अम्लों के साथ अभिक्रिया उदासीनीकरण अभिक्रिया कहलाती है। जिसके फलस्वरूप संगत लवण तथा जल बनते हैं।
(iii) क्षारक अधात्विक ऑक्साइडों से अभिक्रिया करके लवण तथा जल बनाते हैं।
क्षारक + अधात्विक ऑक्साइड → लवण + जल
क्योंकि यह अभिक्रिया अम्ल और क्षारक के मध्य अभिक्रिया जैसी है अतः हम यह निष्कर्ष निकाल सकते हैं कि अधात्विक ऑक्साइडों की प्रकृति अम्लीय होती है।
(iv) क्षारक जल में घोले जाने पर हाइड्रॉक्साइड आयन (OH– ) उत्पन्न करते हैं।
उदाहरण NaOH (s) -(जल)→ Na+ (aq) + OH– (aq)
सोडियम हाइड्रॉक्साइड
सभी क्षारक जल में घुलनशील नहीं होते हैं। जल में घुलनशील क्षारक को क्षार कहते हैं। उदाहरण NaOH, KOH, Ca(OH)2, NH4OH, आदि। अतः सभी क्षार क्षारक हैं लेकिन सभी क्षारक क्षार नहीं होते हैं।
(v) तेल और गंधक क्षार में घुल जाते हैं। क्षार जैसे जिंक, ऐलुमिनियम, टिन, आदि के ऑक्साइड और हाइड्रॉक्साइड अम्ल के साथ-साथ गर्म सान्द्र NaOH और KOH के विलयनों में भी घुल जाते हैं। अतः ये उभयधर्मी (amphoteric) कहलाते हैं।
(vi) प्रबल क्षार जैसे NaOH, KOH आदि अपने जलीय विलयन तथा गलित अवस्था में विद्युत के अच्छे चालक हैं क्योंकि इन अवस्थाओं में ये शीघ्रता से आयन उपलब्ध कराते हैं।
क्षारकों के उपयोग (Uses of Bases)
(i) कैल्सियम हाइड्रॉक्साइड (Calcium Hydroxide) [Ca(OH)2] इसका उपयोग विरंजक पाउडर के निर्माण में, कंकरीट और प्लास्टर में, चूना पोतने में, जल के. मृदुकरण में और अम्लीय मृदा को उपचारित करने में किया जाता है। इसकी सहायता से चमड़े की बाहरी सतह पर स्थित बालों को भी हटाया जा सकता है।
(ii) मैग्नीशियम हाइड्रॉक्साइड (Magnesium Hydroxide) [Mg(OH)2] इसका उपयोग प्रतिअम्ल के रूप में और चीनी उद्योग में किया जाता है।
(iii) सोडियम हाइड्रॉक्साइड (Sodium hydroxide) (NaOH) इसे कॉस्टिक सोड़ा भी कहते हैं। इसका उपयोग धातुओं से ग्रीस हटाने में, कागज बनाने में, कठोर साबुन तथा अपमार्जक के निर्माण में तथा टैक्सटाइल उद्योग में किया जाता है। इसके अलावा इसका प्रयोग पेट्रोलियम के शोधन में तथा घरों की सफाई में किया जाता है।
(iv) पोटैशियम हाइड्रॉक्साइड (Potassium Hydroxide) (KOH) इसका उपयोग प्रयोगशाला अभिकर्मक के रूप में, मृदु साबुन, शैम्पू तथा शेविंग क्रीम के निर्माण में किया जाता है। इसमें CO2 तथा SO2 को अवशोषित करने की क्षमता होती है।
(v) कैल्सियम ऑक्साइड (Calcium Oxide ) (CaO) इसका उपयोग शुष्क कारक के रूप में विरंजक चूर्ण के निर्माण में, गारे में एक अवयव के रूप में किया जाता है।
(vi) मैग्नीशियम ऑक्साइड (Magnesium Oxide) (MgO) इसका उपयोग भट्टी में अग्निसह ईटों के निर्माण में, रबड़ पूरक के रूप में तथा बायलरों के प्रयोग में किया जाता है।
अम्ल और क्षारक सम्बन्धी आधुनिक विचार (Modern Concepts of Acids and Bases)
ये निम्न प्रकार हैं

अम्ल तथा क्षारक का तनुकरण (Dissolution of an Acid or a Base in Water)
जल में अम्ल क्षारक के घुलने की प्रक्रिया अत्यन्त ऊष्माक्षेपी होती है अतः सान्द्र अम्ल (या क्षारक) को सदैव धीरे-धीरे जल में हिलाते हुए मिलाना चाहिए। क्योंकि सान्द्र अम्ल में जल मिलाने पर उत्पन्न हुई ऊष्मा के कारण मिश्रण आस्फलित (splash out) होकर हमें जला सकता है या काँच का पात्र टूट सकता है।
अम्ल के विलयन को या क्षार के विलयन को तनुकृत करते समय क्रमशः हाइड्रोनियम आयन या हाइड्रॉक्सिल आयन की सान्द्रता में प्रति इकाई आयतन में कमी हो जाती है। इस प्रक्रिया को तनुकरण (dilution) कहते हैं। अम्ल या क्षारक तनुकृत होते हैं।
लवण (Salts)
अम्लों और क्षारकों की अभिक्रिया से प्राप्त यौगिकों को लवण कहते हैं तथा ऐसी अभिक्रियाएँ उदासीनीकरण अभिक्रियाएँ कहलाती हैं। दूसरे शब्दों में, इन्हें किसी अम्ल के विस्थापनशील H को क्षार द्वारा विस्थापित करके प्राप्त किया जाता है। लवण का धनायन क्षार से तथा लवण का ऋणायन अम्ल से आता है।
NaOH + HCI→ NaCl + H2O
लवण
लवणों के प्रकार (Types of Salts)
विभिन्न प्रकार के लवण निम्न प्रकार हैं
(i) सामान्य लवण (Normal Salts) किसी अम्लीय अणु से धातु द्वारा हाइड्रोजन परमाणुओं के पूर्णतः विस्थापन द्वारा बने लवण को सामान्य लवण कहते हैं। दूसरे शब्दों में, इन लवणों में विस्थापनीय परमाणु नहीं होते हैं।
उदाहरण NaCl, Na2SO4, KNO3, FeSO4, K2SO4, [Ca3 (PO4)2 ] Na3BO3, आदि।
(ii) अम्लीय लवण (Acidic Salts) ये लवण अम्लों के अपूर्ण उदासीनीकरण द्वारा प्राप्त किए जाते हैं अर्थात् क्षारक अथवा धातु द्वारा H-परमाणुओं के आंशिक विस्थापन द्वारा इन्हें प्राप्त किया जाता है। इन लवणों में एक या एक से अधिक विस्थापनीय हाइड्रोजन परमाणु बने रहते हैं।
उदाहरण NaHCO3, NaHSO4, NaH2PO4, आदि।
(iii) क्षारीय लवण ( Basic Salts) इन लवणों में विस्थापनीय एक या अधिक हाइड्रॉक्सिल (OH– ) आयन होते हैं। ये लवण अम्ल द्वारा क्षारक के आंशिक उदासीनीकरण के फलस्वरूप बनते हैं।
उदाहरण Mg(OH) Cl, Zn(OH) Cl, आदि।
◆ यदि एक सामान्य लवण दुर्बल अम्ल तथा प्रबल क्षारक से प्राप्त किया जाता है तो यह लवण क्षारीय कहलाता है। क्योंकि इसका जलीय विलयन लाल लिटमस को नीला कर देता है।
उदाहरण Na2CO3, CH3COONa, Na2B4O7.10H2O, आदि।
◆ यदि एक सामान्य लवण प्रबल अम्ल और प्रबल क्षार की अभिक्रिया से प्राप्त किया जाता है तो प्राप्त लवण उदासीन लवण कहलाता है क्योंकि इसके जलीय विलयन का लिटमस पर कोई प्रभाव नहीं पड़ता है।
उदाहरण NaCl, KCI, K2SO4, NaNO3, KCIO3, आदि।
◆ यदि एक सामान्य लवण प्रबल अम्ल तथा दुर्बल क्षारक की अभिक्रिया से प्राप्त होता है तो प्राप्त लवण अम्लीय होता है क्योंकि इसका जलीय विलयन नीले लिटमस को लाल कर देता है।
उदाहरण FeCl3, CuSO4, ZnCl2, FeSO4, HgSO4, आदि।
(iv) द्विक लवण (Double Salts) ये दो सरल लवणों के संयोग से बने होते हैं। इनका अस्तित्व केवल ठोस अवस्था में होता है। इनमें रवा जल भी होता है। उदाहरण मोहर लवण [FeSO4. (NH4)2SO4.6H2O], पोटाश एलम [ K2SO4 · Al2 (SO4)3 .24H2O], आदि। ये लवण सूत्र में उपस्थित सभी आयनों (अवयवों) का परीक्षण देते हैं।
(v) संकर लवण (Complex Salts) ये वे यौगिक होते हैं जिनमें धातु आयन निश्चित संख्या में ऋणायन अथवा उदासीन अणुओं, जिन्हें लिगेण्ड कहते हैं, से बन्धन करके संकुलन स्पीशीज बनाते हैं जिनके अपने अभिलाक्षणिक गुण होते हैं। इनका अस्तित्व विलयन में होता है। उदाहरण पोटैशियम हेक्सासायनोंफैरेट (III), K4[Fe(CN)6] में [Fe(CN)6]4- संकर आयन है तथा ट्रेटाऐमीनोक्यूप्रिकसल्फेट [Cu(NH3)4]SO4 में [Cu(NH3)4]2+ संकर आयन है।
(vi) मिश्रित लवण (Mixed Salts) इन लवणों में एक से अधिक क्षारीय या अम्लीय मूलक (धनायन या ऋणायन) होते हैं। उदाहरण विरंजक चूर्ण [Ca(OCI)Cl] सोडियम पोटैशियम सल्फेट (NaKSO4) एवं रोशेल लवण, आदि।
कुछ सामान्य लवणों के उपयोग (Uses of Some Common Salts)
(i) सोडियम क्लोराइड (Sodium Chloride) (NaCl) इसे सामान्य लवण या चट्टानी नमक भी कहते हैं। इसके क्रिस्टल अशुद्धियों की उपस्थिति के कारण भूरे रंग के दिखाई देते हैं। यह हमारे भोजन का आवश्यक अंग है। यह विभिन्न खाद्य पदार्थों जैसे अचार के परिरक्षण में प्रयुक्त किया जाता है। यह प्रतिदिन उपयोग में आने वाले अनेक यौगिकों जैसे विरंजक चूर्ण, बेकिंग सोडा, सोडियम हाइड्रॉक्साइड के निर्माण में प्रयुक्त होने वाला कच्चा पदार्थ है। हमारे स्वतन्त्रता संग्राम में नमक एक महत्त्वपूर्ण प्रतीक था ( महात्मा गाँधी की दांडी यात्रा)।
(ii) सोडियम बाईकार्बोनेट (Sodium Bicarbonate) (NaHCO3) इसे बेकिंग सोडा भी कहते हैं। इसका उपयोग बेकिंग पाउडर (जो बेकिंग सोडा तथा टार्टरिक अम्ल का मिश्रण है) बनाने में, सोडा अम्ल अग्निशामक में, प्रतिअम्ल के रूप में किया जाता है।

pH स्केल (pH Scale)
pH मूल्य किसी पदार्थ की अम्लीयता और क्षारीयता की माप है | pH स्केल वह स्केल है, जो किसी विलयन में उपस्थित हाइड्रोजन आयन की सान्द्रता ज्ञात करने के लिए प्रयुक्त किया जाता है | pH में p सूचक है पुसांस (Potenz) जो एक जर्मन शब्द है इसका अर्थ होता है ‘शक्ति’। इस स्केल से सामान्यतः शून्य (अधिक अम्लता) से चौदह (अधिक क्षारीय) तक pH को ज्ञात कर सकते हैं। हाइड्रोनियम आयन की सान्द्रता जितनी अधिक होगी उसका pH उतना ही कम होगा।
किसी विलयन में उपस्थित हाइड्रोजन आयन की सान्द्रता (मोल प्रति लीटर में) के ऋणात्मक 10 आधारीय लघुगुणकीय मान को pH कहते हैं।
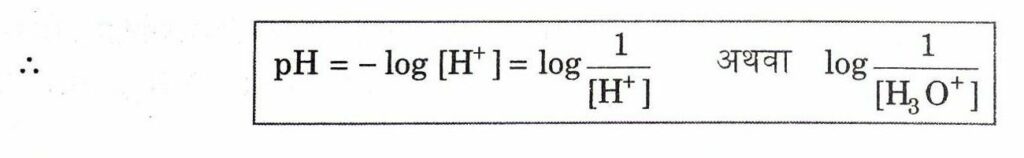
क्योंकि H+ सामान्य H3O+ ( हाइड्रोनियम आयन) के रूप में रहता है।
उदासीन विलयन का pH = 7
अम्लीय विलयन का pH <7
क्षारीय विलयन का pH > 7
सामान्यतः सार्वभौम सूचक, (वह पदार्थ जो विभिन्न pH वाले विलयन में भिन्न-भिन्न रंग देता है), से संसेचित पेपर जिसे pH पेपर कहते हैं, को pH मापने के लिए प्रयुक्त किया जाता है ।
अम्ल तथा क्षारक की शक्ति विलयन (जल) में क्रमश: H+ आयन तथा OH– आयन की संख्या पर निर्भर करती है। अधिक संख्या में H+ आयन उत्पन्न करने वाले अम्ल प्रबल अम्ल कहलाते हैं जबकि कम H+ आयन उत्पन्न करने वाले अम्ल दुर्बल अम्ल कहलाते हैं ।

◆ वायु के सम्पर्क में आने पर ताजे भौम जल का pH हल्का-सा घट जाता है। क्योंकि वायु में उपस्थित CO2 जल में घुलकर दुर्बल अम्ल H2CO3 (कार्बोनिक अम्ल) बनाती है। यह अम्ल H+ देता है जिसके कारण जल हल्का अम्लीय हो जाता है तथा pH घट जाता है।
◆ जब क्षारक को अम्लीय विलयन में मिलाया जाता है तो विलयन का pH बढ़ जाता है लेकिन अम्ल को क्षारीय विलयन में मिलाने पर विलयन का pH घट जाता है।
◆ यदि प्रबल अम्ल जैसे HCI, H2SO4 को समान तुल्यांक के प्रबल क्षारक जैसें (सोडियम हाइड्रॉक्साइड), KOH (पोटैशियम हाइड्रॉक्साइड) में मिलाते हैं तो पूर्ण उदासीनीकरण के साथ विलयन का pH 7 हो जाता है।
◆ जब किसी विलयन को जल में मिलाकर तनुकृत किया जाता है, तो इसका pH घट जाता है। उदाहरण pH 6 वाले विलयन को तनुकृत करने पर इसका pH घट जाता है और यह अम्लीय ही रहता है। क्योंकि जल में आयनीकरण बढ़ जाता है।
दैनिक जीवन में pH का महत्त्व (Importance of pH in Everyday Life)
1. पौधे और पशु pH के प्रति संवेदनशील होते हैं। हमारा शरीर 7.0 से 7.8 pH परास के बीच कार्य करता है। जीवित प्राणी केवल संकीर्ण pH परास (परिसर) में ही जीवित रह सकते हैं। जब नदी के जल का pH अम्लीय वर्षा के कारण घट जाता है तो ऐसी नदी में जलीय जीवधारियों की उत्तरजीविता कठिन हो जाती है। अच्छी उपज के लिए ( पौधों को अच्छी वृद्धि के लिए) पौधों को विशिष्ट pH परास की आवश्यकता होती है।
2. उर्वरकों के अत्यधिक प्रयोग से मृदा अम्लीय हो जाती है, जो पौधों की वृद्धि के लिए अच्छा नहीं है। अतः मृदा को पौधों की वृद्धि के अनुरूप बनाने के लिए इसमें उचित मात्रा में (मृदा के परीक्षण के उपरान्त) कुछ क्षारक जैसे क्विक लाइम (चूना, कैल्सियम ऑक्साइड) अथवा बुझा चूना (कैल्सियम हाइड्रॉक्साइड) मिला दिये जाते हैं, जो मृदा में उपस्थित अम्ल को उदासीन कर देते हैं। यदि मृदा अधिक क्षारीय हो जाती है, तो इसमें कार्बनिक पदार्थ, जो अम्ल मुक्त करते हैं, मिला दिए जाते हैं।
3. कारखानों से निकलने वाले वाहित जल में अनेकों अम्ल होते हैं, जो नदी या झील में मिलकर इसे प्रदूषित करते हैं। अतः इसमें उपस्थित अम्ल को उदासीन करने के लिए इसमें कुछ क्षारीय पदार्थ मिला दिए जाते हैं।
4. हमारा उदर भोजन के पाचन के लिए हाइड्रोक्लोरिक अम्ल उत्पन्न करता है। अपच की स्थिति में उदर द्वारा अत्यधिक मात्रा में अम्ल उत्पन्न करने से जलन व दर्द का अनुभव होता है, जिससे मुक्त होने के लिए क्षारक, जो प्रतिअम्ल कहलाते हैं जैसे मिल्क ऑफ मैग्नीशिया (दुर्बल क्षारक), का उपयोग किया जाता है। ये प्रतिअम्ल आधिक्य ( आवश्यकता से अधिक) अम्ल को उदासीन कर देते हैं।
5. मुँह के pH का मान 5.5 से कम होने पर दाँतों का क्षय आरम्भ हो जाता है। मुँह में अवशिष्ट शर्करा एवं खाद्य पदार्थों का बैक्टीरिया द्वारा निम्नीकरण करने से अम्ल उत्पन्न होता है। अम्ल दाँतों के इनैमल, जो कैल्सियम फॉस्फेट से बना होता है, को संक्षारित करता है। दन्त मंजन सामान्यतः क्षारीय होते हैं इनके उपयोग द्वारा अम्ल की आधिक्य मात्रा को उदासीन करके दन्त क्षय रोका जा सकता है।
6. मधुमक्खी के डंक मारने पर या चींटी के काटने पर अम्ल (फॉर्मिक अम्ल) के शरीर के छोड़ने के कारण दर्द व जलन का अनुभव होता है। प्रभावित अंग में बेकिंग सोडा (सोडियम हाइड्रोजन कार्बोनेट) या कैलेमाइन (जिंक कार्बोनेट) जैसे दुर्बल क्षारक रगड़ने से आराम मिलता है।
7. केले के पत्तों की प्रकृति क्षारीय होती है। अतः यह यीस्ट की वृद्धि को रोकता है। यही कारण है कि दूधिया दूध के डिब्बों में केले की पत्ती रखते हैं।
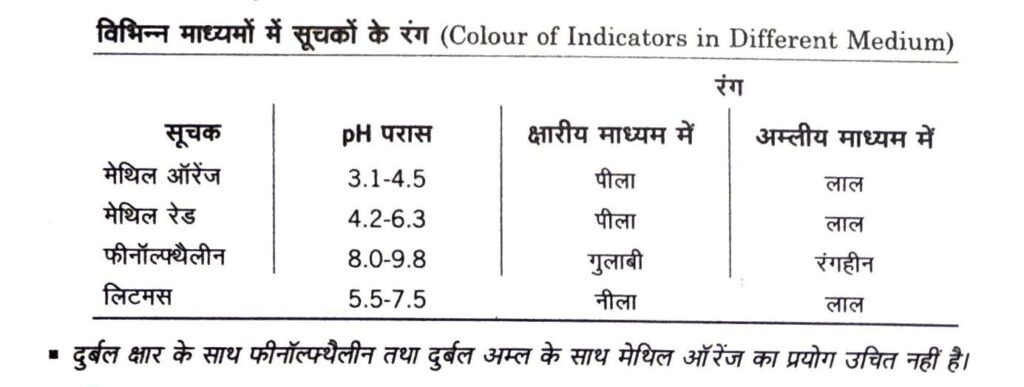
सूचक (Indicators)
सूचक रंग में परिवर्तन के द्वारा विलयन के pH में परिवर्तन को दर्शातें हैं। अतः सूचकों का प्रयोग किसी विलयन की प्रकृति अम्लीय, क्षारीय अथवा उदासीन है ज्ञात करने के लिए किया जाता है। विलयन का pH, pH पेपर या सार्वभौम सूचक या pH मीटर द्वारा ज्ञात किया जा सकता है। लिटमस, हल्दी, गुड़हल, हायड्रेजिया, ट्यूनिया, जेरानियम की पंखुड़ियाँ प्राकृतिक सूचक हैं।
अम्ल- क्षार सूचक (Acid-Base Indicators)
ये दुर्बल कार्बनिक अम्ल या फिर दुर्बल कार्बनिक क्षारक होते हैं। उदाहरण फीनॉल्फ्थैलीन एक दुर्बल कार्बनिक अम्ल है तथा मेथिल ऑरेंज एक दुर्बल कार्बनिक क्षारक है।
बफर विलयन (Buffer Solution)
ऐसे विलयन, जिनका pH तनु करने अथवा अम्ल या क्षारक की थोडी-सी मात्रा मिलाने के बाद भी अपरिवर्तित रहता है, ‘बफर-विलयन’ कहलाते हैं ।
बफर विलयन के प्रकार (Types of Buffer Solutions)
ये दो प्रकार के होते हैं
(i) अम्लीय बफर (Acidic Buffer) किसी दुर्बल अम्ल तथा इसका प्रबल क्षार के साथ लवण का समान मात्रा में मिश्रण अम्लीय बफर कहलाता है। ऐसीटिक अम्ल व सोडियम ऐसीटेट का मिश्रण, हाइड्रोजन सायनाइड व पोटैशियम सायनाइड का मिश्रण तथा बोरिक अम्ल और बोरेक्स का मिश्रण अम्लीय बफर के उदाहरण हैं। ऐसीटिक अम्ल और सोडियम ऐसीटेट से बने अम्लीय बफर का pH 4.75 (लगभग) होता है।

(ii) प्रबल अम्ल और दुर्बल क्षारक के लवण ( Salts of Strong Acids and Weak Bases) अमोनियम क्लोराइड, अमोनियम हाइड्रॉक्साइड (दुर्बल क्षारक) तथा हाइड्रोक्लोरिक अम्ल प्रबल अम्ल का लवण है। अतः जल-अपघटन के फलस्वरूप यह अम्लीय विलयन देता है। इसके विलयन का pH मान 7 से कम है।
(iii) दुर्बल अम्ल और दुर्बल क्षारक के लवण ( Salts of Weak Acids and Weak Bases) अमोनियम ऐसीटेट, ऐसीटिक अम्ल दुर्बल अम्ल तथा अमोनियम हाइड्रॉक्साइड दुर्बल क्षारक का लवण है। इस प्रकार के लवण का जलीय विलयन अम्लीय या क्षारीय या उदासीन हो सकता है।
(iv) प्रबल अम्ल और प्रबल क्षारक के लवण (Salts of Strong Acids and Strong Bases) सोडियम या पोटैशियम के हैलाइड, सल्फेट तथा नाइट्रेट लवणों के इस वर्ग के उदाहरण हैं। अम्ल तथा क्षार दोनों ही प्रबल हैं। अतः जल-अपघटन की प्रक्रिया नहीं होती है। इनके जलीय विलयन उदासीन (neutral) रहते हैं तथा इस प्रकार के लवणों का जलीय विलयन का pH मान 7 होता है।
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here