परमाणु संरचना (Atomic Structure)
परमाणु संरचना (Atomic Structure)
परमाणु संरचना (Atomic Structure)
19वीं शताब्दी तक यह माना जाता रहा कि परमाणु सबसे छोटा कण है। परमाणु की संरचना को समझानें तथा इसके मुख्य गुणों को स्पष्ट करने के लिए शृंखलागत प्रयोग किए गए। इन प्रयोगों ने परमाणु के अवपरमाण्विक कणों में विभाज्यता का संकेत दिया और दिखाया कि परमाणु का एक निश्चित आन्तरिक विन्यास (internal configuration) और संघटन होता है।
डाल्टन का परमाणु सिद्धान्त (Dalton’s Atomic Theory)
सन् 1808 में जॉन डाल्टन ने ‘A New System of Chemical Philosophy’ नामक पुस्तक प्रकाशित की। उसमें इन्होंने निम्न सिद्धान्त प्रस्तुत किये
(i) द्रव्य अविभाज्य परमाणुओं से बना है।
(ii) किसी दिए हुए तत्व के सभी परमाणुओं के एक समान द्रव्यमान सहित एक समान गुणधर्म होते हैं। विभिन्न तत्वों के परमाणु द्रव्यमान में भिन्न होते हैं।
(iii) एक से अधिक तत्वों के परमाणुओं के निश्चित अनुपात में संयोजन से यौगिक बनते हैं।
(iv) रासायनिक अभिक्रियाओं में परमाणु पुनर्व्यवस्थित होते हैं। रासायनिक अभिक्रियाओं में न तो उन्हें बनाया जा सकता न ही नष्ट किया जा सकता है।
(v) डाल्टन के परमाणु सिद्धान्त ने रासायनिक संयोजन के नियमों की व्याख्या की।
अवपरमाण्विक कण और इनके गुणधर्म (Subatomic Particles and their Properties)
डाल्टन का परमाणु सिद्धान्त अधिक समय तक नहीं चल सका। अनुसन्धानकर्ताओं जैसे जे जे थॉमसन (1897), रदरफोर्ड (1911), नील्स बोर (1912), वेक्टर, चैडविक, मोजले, आदि ने प्रयोगों द्वारा यह सिद्ध किया कि परमाणु कई प्रकार के अतिसूक्ष्म कणों जैसे इलेक्ट्रॉन, प्रोटॉन, न्यूट्रॉन, पॉजिट्रान, न्यूट्रिनो, मेसॉन, आदि से मिलकर बना है जिन्हें अवपरमाण्विक कण कहते हैं। यद्यपि प्रथम तीन कणों को मूलभूत कण (fundamental particles) माना जाता है तथा बाद वाले कण सूक्ष्म कण विनिमय क्रियाविधि के दौरान केवल थोड़े समय के लिए प्रकट होते हैं। अतः ये मूलभूत कण नहीं हैं।
मौलिक कण (Fundamental Particles)
इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन परमाणु के मौलिक कण है, जिनकी खोज और गुण इस प्रकार हैं
(a) इलेक्ट्रॉन की खोज (-1e0 ) (Discovery of Electron) इलेक्ट्रॉन की खोज जे जे थॉमसन द्वारा सन् 1897 में कैथोड किरण प्रयोग में की गई। इस प्रयोग में जब विसर्जन नलिका में दाब को निर्वातन द्वारा 10-6 वायु पर नियन्त्रित करके उच्च वोल्टता लागू की गई, तो कैथोड से ऋणावेशित कणों की धारा, जिन्हें इलेक्ट्रॉन कहते हैं, आरम्भ हुई। इन किरणों को कैथोड किरणें (cathode rays) कहा गया।
कैथोड किरणों के निम्नलिखित लक्षण हैं
(i) ये किरणें स्वयं दिखाई नहीं देती परन्तु इनके व्यवहार को गैसों तथा कुछ स्फुरदीप्त (fluorescent) तथा प्रतिदीप्त (phosphorescent) पदार्थों की उपस्थिति में देखा जा सकता है। (टेलीविजन चित्र नलिका कैथोड नलिका होती है)।
(ii) विद्युत और चुम्बकीय क्षेत्रों की उपस्थिति में कैथोड किरणों का व्यवहार ऋणावेशित कणों, जिन्हें इलेक्ट्रॉन कहते हैं, के अपेक्षित व्यवहार के समान होता है।
(iii) आर ए मिलिकन ने तेल बूँद प्रयोग (oil drop experiment ) द्वारा इलेक्ट्रॉन पर आवेश, -1.602 x 10-19 C ज्ञात किया ।
(iv) जे जे थॉमसन ने इलेक्ट्रॉन का द्रव्यमान 9.11 x 10-31 kg निर्धारित किया। परमाणु के तीनों मूलभूत कणों में इलेक्ट्रॉन सबसे हल्का है।
(v) थॉमसन ने इलेक्ट्रॉन के लिए e/m का मान 1.76 x 1018 C/g निर्धारित किया।
(vi) इलेक्ट्रॉन के लिए e/m का मान गैस की प्रकृति और प्रयुक्त इलेक्ट्रोड पर निर्भर नहीं करता है। अतः इलेक्ट्रॉन सभी प्रकार के पदार्थों का मूलभूत कण है।
(b) प्रोटॉन (11H) की खोज (Discovery of Proton) इलेक्ट्रॉन के पहचाने जाने से पूर्व ही ई गोल्डस्टीन ने सन् 1886 में एक नए विकिरण की खोज की जिसे उन्होंने केनाल रे (canal ray) का नाम दिया। ये किरणें धनावेशित विकिरण थीं, जिसके द्वारा अंततः दूसरे अवपरमाणुक कणों की खोज हुई। इस अवपरमाणुक कण पर आवेश इलेक्ट्रॉन के आवेश के बराबर, किन्तु विपरीत था। इसे प्रोटॉन नाम रदरफोर्ड ने सन् 1919 में दिया। प्रोटॉन का द्रव्यमान 1.67 x 10-27 kg जबकि इस पर आवंश +1.6 × 10-19C होता है।
(c) न्यूट्रॉन (10n) की खोज (Discovery of Neutron) नाभिक पर धनावेश इसमें उपस्थित धनावेशित कण प्रोटॉनों के कारण होता है। लेकिन नाभिक का द्रव्यमान केवल प्रोटॉनों के कारण नहीं होता। सन् 1932 में चैडविक ने बेरीलियम पर α- कणों के प्रहार से एक ओर अवपरमाणुक कण जिसे न्यूट्रॉन कहा गया, की खोज की। न्यूट्रॉन विद्युत उदासीन कण है अर्थात् इस पर आवेश नहीं होता है। इसका द्रव्यमान प्रोटॉन की अपेक्षा हल्का सा अधिक है।
◆ इलेक्ट्रॉन का द्रव्यमान नगण्य तथा इस पर आवेश -1 माना जाता है।
◆ प्रोटॉन का द्रव्यमान एक इकाई तथा इस पर आवेश +1 माना जाता है।
◆ न्यूट्रॉन का द्रव्यमान 1.67× 10-27 kg (लगभग प्रोटॉन के बराबर) होता है।
◆ हाइड्रोजन अर्थात् प्रोटियम के परमाणु में न्यूट्रॉन नहीं होते हैं।
◆ आधुनिक परमाणु सिद्धान्त के जन्मदाता जॉन डाल्टन को माना जाता है।
◆ स्केनिंग टनेलिंग माइक्रोस्कोप (scanning tunneling microscope) का प्रयोग करके परमाणुओं को देखा जा सकता है।
◆ उत्कृष्ट गैसों को छोड़कर सभी के परमाणु अभिक्रियाशील होते हैं।
◆ हीलियम (He) का परमाणु सबसे छोटा होता है। इसकी त्रिज्या 32 x 10-12 मी होती है, जबकि सीजियम (Cs) का परमाणु सबसे बड़ा होता है और इसकी त्रिज्या 225 x 10-12 मी होती है ।
अस्थाई मौलिक कण (Non-Fundamental Particles)
इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के अलावा दूसरे कणों को अस्थाई मौलिक कण कहा जाता है।
(a) पॉजिट्रॉन (Positron) सन् 1932 में इसकी खोज एण्डरसन ने की थी। यह इलेक्ट्रॉन का प्रतिकण (antiparticle) है। यह धनावेशित कण है इसका द्रव्यमान इलेक्ट्रॉन के द्रव्यमान के बराबर है। इसका प्रतीक e+ है।
(b) एन्टीप्रोटॉन (Antiproton) यह प्रोटॉन का प्रतिकण है। इसकी खोज सन् 1955 में सीगर ने की थी। इस पर आवेश -e है और इसका द्रव्यमान प्रोटॉन के द्रव्यमान के बराबर है। इसका प्रतीक p है।
◆ प्रत्येक मौलिक कण के लिए कुछ गुणों में विपरीत वाला समान मौलिक कण पाया जाता है। जिसे प्रतिकण (antiparticle) कहते हैं। उदाहरण इलेक्ट्रॉन तथा पॉजिट्रॉन सभी दृष्टि से समान है, परन्तु दोनों पर विपरीत आवेश होता है। अतः पाजिट्रॉन, इलेक्ट्रॉन का प्रतिकण है।
(c) न्यूट्रिनो तथा एन्टिन्यूट्रिनो (Neutrino and Antineutrino) सन् 1930 में पाउली ने रेडियो सक्रिय नाभिक से β-कण के उत्सर्जन की व्याख्या करते समय इन कणों की भविष्यवाणी की थी। लेकिन वास्तव में ये कण प्रायोगिक तौर पर सन् 1956 में ज्ञात हुए। ये द्रव्यमान और आवेश रहित मूल कण हैं। (द्रव्यमान और आवेश दोनों शून्य) लेकिन ऊर्जा और संवेग इनमें होता है। न्यूट्रिनों तथा एन्टिन्यूट्रिनों के चक्रण एवं रेखीय संवेग की दिशाएँ एक दूसरे के विपरीत होते हैं। अतः ये आपस में एक दूसरे के प्रतिकण (antiparticle) है। इनका प्रतीक ν हैं।
(d) पाई मेसॉन (Pi-meson) इनके अस्तित्व की भविष्यवाणी युकावा ने सन् 1935 में की थी। लेकिन वास्तव में ये कॉस्मिक किरणों में सन् 1947 में खोजा गया। नाभिकीय बलों की व्याख्या न्यूक्लिऑनों के मध्य π-मेसॉन के विनिमय द्वारा की जाती है। π- मेसॉन तीन प्रकार के होते हैं। धनात्मक π- मेसॉन (π+), ऋणात्मक π- मेसॉन (π–) तथा उदासीन π-मेसॉन (π0) | π+ का द्रव्यमान इलेक्ट्रॉन के द्रव्यमान का 274 गुना होता है। तथा π0 का द्रव्यमान इलेक्ट्रॉन के द्रव्यमान का 264 गुना होता है।
(e) क्वार्क और बोसॉन (Quark and Boson) वे बुनियादी कण जिनसे दूसरे भारी अवपरमाण्विक कण जैसे प्रोटॉन, न्यूट्रॉन, आदि बने हैं, क्वार्क कहलाते हैं। इन पर भिन्नात्मक आवेश (fractional charge) होता है। बोसॉन वे कण है जिनके घूर्णनों की संख्या पूर्णांक होती हैं।
बोसॉन → मेसॉन + फोटॉन
◆ π– मेसॉन, बोसॉन और क्वार्क किसी मौलिक कण के प्रतिकण नहीं हैं।
◆ किसी परमाणु में इनका श्रेणीकरण इनके द्रव्यमानों के आधार पर किया जाता है।
◆ विशेष रूप से प्रोटॉन तथा न्यूट्रॉन दोनों तीन क्वार्कों से मिलकर बने हैं।
पूर्व परमाणु मॉडल (Earlier Atomic Models)
किसी परमाणु में आवेशित कण जैसे इलेक्ट्रॉन, प्रोटॉन तथा न्यूट्रॉन के वितरण की व्याख्या करने के लिए विभिन्न परमाणु मॉडल प्रस्तावित किये गए।
थॉमसन का परमाणु मॉडल (Thomson’s Atomic Model)
थॉमसन ने परमाणु संरचना से सम्बन्धित एक मॉडल, जो कि क्रिसमस पुडिंग के समान था, प्रस्तुत किया। थॉमसन ने प्रस्तावित किया कि
(i) परमाणु धनावेशित गोले का बना होता है और इलेक्ट्रॉन उसमें धँसे होते हैं।
(ii) ऋणात्मक और धनात्मक आवेश परिमाण में समान होते हैं। इसलिए परमाणु विद्युतीय रूप से उदासीन होते हैं।
कमियाँ (Drawbacks) यद्यपि यह मॉडल परमाणु की विद्युत उदासीनता को स्पष्ट करता था लेकिन दूसरे वैज्ञानिकों के प्रयोगों के परिणामों (जैसे α-कण प्रकीर्णन प्रयोग) को इस मॉडल द्वारा नहीं समझाया जा सकता है।
रदरफोर्ड का परमाणु मॉडल (Rutherford’s Atomic Model)
रदरफोर्ड और उसके विद्यार्थियों ने हंस गीगर और अर्नेस्ट मार्सडेन) सन् 1911 में α- कण प्रकीर्णन प्रयोग किया। जिसमें उन्होंने सोने की पतली पन्नी पर α-कणों की बौछार की । प्रेक्षणों और परिणामों के आधार पर रदरफोर्ड ने परमाणु का नाभिकीय मॉडल प्रस्तुत किया। इस मॉडल के अनुसार
(i) परमाणु का केन्द्र धनावेशित होता है, जिसे नाभिक (nucleus) कहा जाता है। परमाणु का लगभग सम्पूर्ण द्रव्यमान नाभिक में होता है। अर्थात् प्रोटॉन और न्यूट्रॉन नाभिक में भरें होते हैं।
(ii) इलेक्ट्रॉन नाभिक के चारों ओर वृत्ताकार पथों, जिन्हें कक्षा (orbit) कहा जाता है, में चक्कर लगाते हैं। इस प्रकार परमाणु का अधिकांश भाग रिक्त होता है।
(iii) नाभिक का आकार परमाणु के आकार की तुलना में काफी कम होता है।
कमियाँ (Drawbacks) कलार्क मैक्सवैल के विद्युत गतिकी (electrodynamics) के सिद्धान्त के अनुसार, यदि किसी गतिशील विद्युत आवेशित कण को त्वरित किया जाए तो उससे उर्जा का विकिरण होगा। इस प्रकार घूमते हुए इलेक्ट्रॉन की ऊर्जा घटती जाएगी। यह नाभिक के पास और पास आयेगा और अन्ततः नाभिक में गिर जाएगा। यदि ऐसा होता है, तो परमाणु को बहुत अधिक अस्थाई होना चाहिए। लेकिन हम जानते हैं परमाणु सचमुच स्थाई है। अतः यह मॉडल छोड़ दिया गया।
बोर का परमाणु मॉडल (Bohr’s Atomic Model)
बोर के अनुसार, अवपरमाण्विक कणों के विषय में पुराने पारम्परिक नियम वैद्य नहीं रह सकते हैं। रदरफोर्ड के मॉडल पर उठी आपत्तियों को दूर करने के लिए नील्स बोर (1913) ने मैक्स प्लांक के क्वाण्टम सिद्धान्त का उपयोग किया और प्लांक क्वाण्टम सिद्धान्त के आधार पर परमाणु मॉडल के विषय में निम्न अवधारणाएँ प्रस्तुत की।
(i) इलेक्ट्रॉन लगातार बिना ऊर्जा खोए अपनी अनुमत कक्षाओं (respective orbits) में घूमते रहते हैं। इस प्रकार प्रत्येक कक्षा की ऊर्जा की मात्रा निश्चित होती है। अतः इन्हें ऊर्जा स्तर (energy level) भी कहते हैं। चित्र में एक परमाणु के ऊर्जा स्तरों को दिखाया गया है

कमियाँ (Drawbacks)
(i) यह मॉडल हाइड्रोजन के अलावा अन्य परमाणुओं से स्पेक्ट्रम की व्याख्या करने में असफल रहा। उदाहरण के लिए, हीलियम परमाणु जिसमें केवल दो इलेक्ट्रॉन हैं।
(ii) यह जीमन प्रभाव (चुम्बकीय क्षेत्र में स्पेक्ट्रमी रेखाओं का विपाटन) और स्टार्क प्रभाव (विद्युत क्षेत्र में स्पेक्ट्रमी रेखाओं का विपाटन) को स्पष्ट करने में असफल रहा।
(iii) यह परमाणुओं के रासायनिक आबन्धों द्वारा अणु बनाने की योग्यता की व्याख्या नहीं कर सका।
परमाणु के अभिलक्षण (Characteristics of an Atom)
परमाणु संख्या और द्रव्यमान संख्या किसी परमाणु के अभिलाक्षणिक गुण होते हैं। जिनका वर्णन नीचे दिया गया है
परमाणु संख्या या परमाणु क्रमांक (Atomic Number) (Z)
यह किसी तत्व का मौलिक अभिलक्षण है। एक परमाणु के नाभिक में उपस्थित प्रोटॉनों की संख्या उसकी परमाणु संख्या को बताती है। इसे Z से निरूपित करते हैं। परमाणु की उदासीनता को बनाए रखने के लिए किसी परमाणु में प्रोटॉनों की संख्या इलेक्ट्रॉनों की संख्या के बराबर होती है। उदाहरण ऑक्सीजन परमाणु में 8 इलेक्ट्रॉन और 8 न्यूट्रॉन होते हैं। अतः इसकी परमाणु संख्या 8 है।
[परमाणु संख्या (Z) = नाभिक में प्रोटॉनों की संख्या = परमाणु में इलेक्ट्रॉनों की संख्या]
मोसले का नियम (Moseley’s Law)
मोसले ने दर्शाया कि, परमाणु द्रव्यमान की तुलना में किसी तत्व का परमाणु क्रमांक उस तत्व के गुणों को दर्शाने में अधिक सक्षम है। उन्होंने तत्वों के अभिलाक्षणिक गुणों की तुलना सरल वक्रों की सहायता से परमाणु द्रव्यमान और परमाणु संख्या के साथ अलग अलग की और इस निष्कर्ष पर पहुँचे कि परमाणु संख्या के पक्ष में परिणाम अधिक यथार्थ और परिशुद्ध हैं।
द्रव्यमान संख्या (Mass Number ) (A)
नाभिक में उपस्थित प्रोटॉनों तथा न्यूट्रॉनों की कुल संख्या अर्थात् न्यूक्लिऑनों की संख्या को परमाणु की संख्या (A) कहते हैं। उदाहरण ऑक्सीजन में 8 प्रोटॉन और 8 न्यूट्रॉन होते हैं। अतः इसकी द्रव्यमान संख्या 16 है।


कक्षक (Orbitals)
किसी परमाणु के नाभिक के चारों ओर त्रिविम का वह क्षेत्र जिसमें इलेक्ट्रॉन के पाए जाने की प्रायिकता सर्वाधिक होती है, कक्षक कहलाती है। प्रत्येक कक्षक में इलेक्ट्रॉनों की संख्या निश्चित होती है। उदाहरण s,p,d और ƒ-कक्षकों में उपस्थित इलेक्ट्रॉनों की अधिकतम संख्या क्रमश: 2, 6, 10 और 14 होती हैं।
कक्षकों का आकार (Shape of Orbitals)
s- कक्षक गोलीय आकृति के तथा सममित विन्यास के होते हैं। n (मुख्य क्वाण्टम संख्या) का मान बढ़ने के साथ s- का आकार भी बढ़ जाता है। सभी s-कक्षकों के लिए, गोलीय नोडों की संख्या (n – 1) होती है जहाँ इलेक्ट्रॉन के पाए जाने की प्रायिकता शून्य होती है।
p-कक्षक संख्या में तीन होते हैं और डम्बल की आकृति के होते हैं। डम्बल की दोनों पालियाँ (lobes) नाभिक से गुजरने वाले तल के दोनों ओर स्थित होती है। जहाँ दोनों पालियाँ एक दूसरे को स्पर्श करती है वहाँ इलेक्ट्रॉन के पाए जाने की प्रायिकता शून्य होती है।
d- कक्षक संख्या में पाँच होते हैं। इनमें से चार डबल डम्बल की आकृति के होते हैं, जबकि पाँचवाँ उच्च इलेक्ट्रॉन घनत्व के कॉलर (collar) के साथ डम्बल की आकृति का होता है।
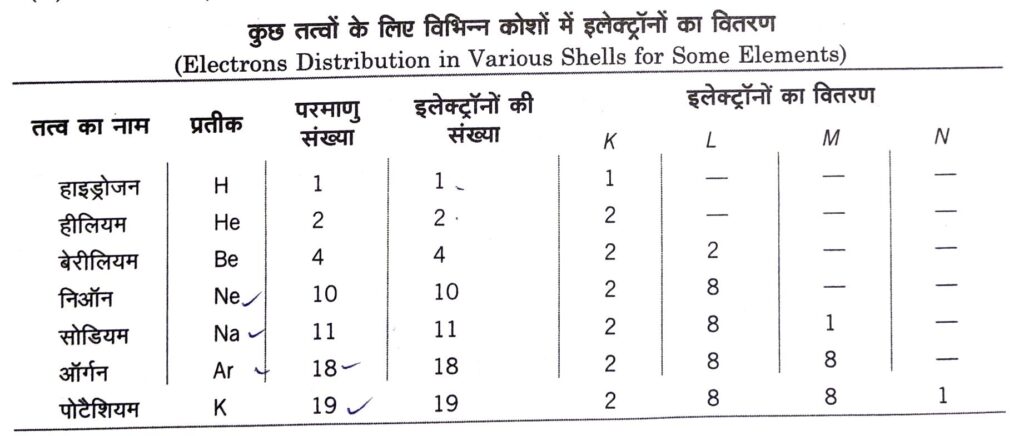
इलेक्ट्रॉनिक विन्यास: विभिन्न कोशों में इलेक्ट्रॉनों का वितरण (Electronic Configuration: Distribution of Electrons in Different Orbits or Shells)
यह किसी परमाणु के विभिन्न कोशों, उपकोशों तथा कक्षकों में इलेक्ट्रॉनों का वितरण है।
बोर – बरी योजना (Bohr-Burry Scheme)
परमाणुओं की विभिन्न कक्षाओं में इलेक्ट्रॉनों के वितरण के लिए बोर और बरी ने सन् 1921 में सुझाव दिए । इनके अनुसार कोशों में इलेक्ट्रॉनों का प्रवेश निम्न नियमों के अनुसार,
(i) किसी कक्षा में उपस्थित अधिकतम इलेक्ट्रॉनों की संख्या को सूत्र 2n2 से दर्शाया जाता है। (n = 1, 2, 3,…… क्रमश: K, L, M, कक्षा के लिए)
(ii) सबसे बाहरी कोश में इलेक्ट्रॉनों की अधिकतम संख्या 8 हो सकती है।
(iii) उपान्तिम ( अन्तिम से ठीक पहली) कक्षा में आठ से अधिक इलेक्ट्रॉन नहीं हो सकते जब तक कि बाह्यतम कक्षा में दो इलेक्ट्रॉन न हो जाएँ।
(iv) बाह्यतम कक्षा में दो इलेक्ट्रॉनों से अधिक होने के लिए उपान्तिम कक्षा में 18 इलेक्ट्रॉन होने चाहिए तथा बाह्यतम कक्षा में दो इलेक्ट्रॉन होने चाहिए।
(v) किसी कक्षा में 18 इलेक्ट्रॉन होने के लिए आन्तरिक कक्षा पूर्ण भरी होनी चाहिए तथा बाह्यतम और अन्तिम कक्षा में क्रमशः 2 और 8 इलेक्ट्रॉन होने चाहिए।
(vi) कोशों में इलेक्ट्रॉन क्रमवार भरे जाते हैं (अर्थात् आन्तरिक से बाहरी) ।
nlx प्रकार योजना (nlx Type Scheme)
यह इस प्रकार लिखा जाता है 2, 8, 8, 18, 32 या nlx, जहाँ, n मुख्य क्वाण्टम संख्या या कोश को इंगित करता है, । द्विगंशी क्वाण्टम या उपकोश को इंगित करता है तथा x इलेक्ट्रॉनों की संख्या है। उदाहरण 2s2 का अर्थ है दो इलेक्ट्रॉन द्वितीय ऊर्जा स्तर के s- उपकोश में हैं।
कक्षकों में इलेक्ट्रॉनों के भरे जाने के नियम (Rules for Filling Electrons in the Orbitals)
विभिन्न कक्षकों में इलेक्ट्रॉन निम्न तीन नियमों द्वारा भरे जाते हैं
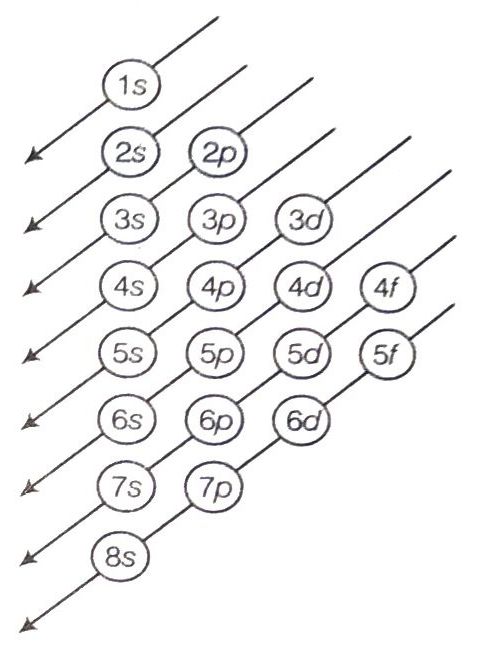
ऑफबाऊ सिद्धान्त (Aufbau Principle)
जर्मन भाषा में ऑफबाऊ का अर्थ है निर्माण होना। कक्षकों का निर्माण होने का अर्थ है कक्षकों का इलेक्ट्रॉनों द्वारा भरा जाना। इस नियम के अनुसार, परमाणुओं की तलस्थ अवस्था में कक्षकों को उनकी ऊर्जा के बढ़ते क्रम में भरा जाता है। अर्थात् इलेक्ट्रॉन पहले सबसे कम ऊर्जा वाले उपलब्ध कक्षक में जाते हैं और उनको भरने के बाद उच्च ऊर्जा वाले कक्षकों को भरते हैं।
कक्षकों की ऊर्जाओं का बढता क्रम इस प्रकार है
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4ƒ < 5d < 6p < 7s, ….
इस प्रकार उच्च ऊर्जा वाले कक्षक अन्त में भरे जाते हैं। इस क्रम को नीचे दिए गए चित्र के द्वारा भी याद किया जा सकता है।
यद्यपि 5g, 6g, 6h, 6ƒ, 7g, 7h, 7d, 7ƒ कक्षक भी सम्भव हैं लेकिन सामान्य दशाओं में इलेक्ट्रॉन इनमें प्रवेश नहीं करते हैं।
उदाहरण
11Na = 1s2, 2s2 2p6,3s1; 7N = 1s2, 2s2 2p3; 8O =1s2, 2s2 2p4
हुण्ड का अधिकतम बहुलता का नियम (Hund’s Rule for Maximum Multiplicity)
इस नियम के अनुसार, एक ही उपकोश के कक्षकों में इलेक्ट्रॉनों का युग्मन तब तक नहीं हो सकता है, जब तक उस उपकोश के सभी कक्षकों में एक-एक इलेक्ट्रॉन न आ जाए, क्योंकि इस प्रकार की दशा में चक्रण बहुलता अथवा स्थायित्व अधिकतम होता है लेकिन ऊर्जा निम्नतम होती है।
संयोजी और कोर इलेक्ट्रॉन (Valence and Core Electrons)
किसी परमाणु की बाह्यतम कक्षा में उपस्थित इलेक्ट्रॉनों को संयोजी इलेक्ट्रॉन कहते हैं। लेकिन परमाणु की आन्तरिक कक्षा में उपस्थित इलेक्ट्रॉनों को कोर इलेक्ट्रॉन कहते हैं।
उदाहरण Mg (12) = (2,8) (2)
कोर इलेक्ट्रॉन संयोजी इलेक्ट्रॉन
तत्वों के रासायनिक गुणधर्म तत्व की संयोजकता पर निर्भर करते हैं। जिसकी गणना इलेक्ट्रॉनो की संख्या द्वारा की जाती है यदि संयोजी इलेक्ट्रॉनों की संख्या 1, 2 या 3 है तो,
संयोजकता = संयोजी इलेक्ट्रॉनों संख्या
यदि संयोजी इलेक्ट्रॉनों की संख्या ≥ 4 है तो,
संयोजकता = 8 – संयोजी इलेक्ट्रॉनों की संख्या
संयोजी इलेक्ट्रॉनों की ऊर्जा कोर इलेक्ट्रॉनों की अपेक्षा उच्च होती है।
क्वाण्टम संख्या (Quantum Numbers)
क्वाण्टम संख्याएँ चार संख्याओं का समूह है, जो निम्न के सम्बन्ध में हमें पूर्ण जानकारी देते हैं
(i) स्थिति और ऊर्जा ( अर्थात् कक्षा संख्या या कोश )
(ii) उपकोश
(iii) अभिविन्यास (उपकोश के आर्बिटल)
(iv) इलेक्ट्रॉन का चक्रण (इलेक्ट्रॉन के चक्रण की दिशा)
मुख्य क्वाण्टम संख्या (n) (Principal Quantum Number)
यह एक धनात्मक पूर्णांक होती है इसका मान 1, 2, 3,….., आदि हो सकता है। इससे इलेक्ट्रॉन के कोश का पता चलता है। यह अकेले ही कक्षक के आकार और ऊर्जा को निर्धारित करता है। n का मान बढ़ने से कक्षक की ऊर्जा बढ़ जाती है। n = 1 दर्शाता है कि इलेक्ट्रॉन अपनी सामान्य अवस्था में है।
द्विगंशी क्वाण्टम संख्या या कोणीय संवेग क्वाण्टम संख्या (l) (Azimuthal Quantum Number or Angular Momentum Quantum Number)
यह घूमते हुए इलेक्ट्रॉन के कोणीय संवेग या उपकोश को बताती है। यह कक्षक के त्रिविमीय आकार को परिभाषित करती है।
यदि l= 0, 1, 2, 3, 4,…..
उपकोश = s, p, d, ƒ,….
मुख्य क्वाण्टम संख्या n के लिए l के मान 0 से (n-1) तक होते हैं ।
उदाहरण यदि n = 1, तो l= 0; यदि_n = 3, तो l= 0, 1, 2
चुम्बकीय क्वाण्टम संख्या (m) (Magnetic Quantum Number)
यह समन्वय अक्ष के संगत कक्षकों के त्रिविम अभिविन्यास अर्थात् अन्तराकाश में कक्षक की दिशा के बारे में जानकारी देती है। इसका मान l के मान पर निर्भर करता है, इसका मान l के किसी एक मान के लिए -l से शून्य सहित +l तक के सभी पूर्णांक होते हैं।
m के कुल मान = (2l + 1) = उपकोश (l) में कक्षकों की संख्या
यदि l = 0, तो m = 0 (केवल 1s – कक्षक है)
यदि l = 1, तो m = – 1, 0, + 1 (तीन p-कक्षक है)
यदि l = 2, तो = – 2, – 1, 0, + 1, + 2 (5d – कक्षक हैं )
चक्रण क्वाण्टम संख्या (s) (Spin Quantum Number)
यह कक्षक में किसी इलेक्ट्रॉन के चक्रण को प्रदर्शित करता है। किसी इलेक्ट्रॉन के लिए दो प्रकार के चक्रण सम्भव हैं। दक्षिणावर्त (clockwise) या वामावर्त (anti-clockwise)। s के मान + 1/2 या – 1/2 हो सकते हैं। चक्रण करते इलेक्ट्रॉन में चक्रण कोणीय संवेग होता है। अतः किसी चुने हुए अक्ष के सापेक्ष दो अभिविन्यास हो सकते हैं। इस प्रकार एक कक्षक में दो से अधिक इलेक्ट्रॉन नहीं हो सकते हैं और इन दोनों इलेक्ट्रॉनों का विपरीत चक्रण होना चाहिए।
पाउली अपवर्जन सिद्धान्त (Pauli Exclusion Principle )
यह क्वाण्टम संख्याओं की अवधारणा की प्रस्तुति के बाद दिया गया। विभिन्न कक्षकों में भरे जाने वाले इलेक्ट्रॉनों की संख्या अपवर्जन सिद्धान्त द्वारा नियन्त्रित होती हैं, जिसे ऑस्ट्रिया के वॉल्फगंग पाउली नामक वैज्ञानिक ने दिया था। इस सिद्धान्त के अनुसार, किसी परमाणु में उपस्थित दो इलेक्ट्रॉनों की चारो क्वाण्टम संख्याएँ एक समान नहीं हो सकती हैं। अर्थात् यदि दो इलेक्ट्रॉनों की तीन क्वाण्टम संख्याएँ n,l और m एक समान हैं, तो उनकी चक्रण क्वाण्टम संख्या (s) भिन्न होनी चाहिए। (यदि एक इलेक्ट्रॉन के लिए + 1/2 है, तो दूसरे के लिए – 1/2 होनी चाहिए) मुख्य क्वाण्टम संख्या n कोश मे अधिकतम इलेक्ट्रॉनों की संख्या 2n2 के बराबर होती है।
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here