द्रव्य और इसकी अवस्थाएँ (Matter and its States)
द्रव्य और इसकी अवस्थाएँ (Matter and its States)
द्रव्य और इसकी अवस्थाएँ (Matter and its States)
द्रव्य (Matter)
अपने चारों ओर नजर दौड़ाने पर हमें विभिन्न प्रकार की वस्तुएँ नजर आती हैं, जिनका आकार, आकृति और बनावट अलग-अलग होती है। इस विश्व में प्रत्येक वस्तु जिस सामग्री से बनी होती है उसे वैज्ञानिकों ने पदार्थ का नाम दिया। सभी वस्तुएँ जैसे पत्थर, बादल, भोजन, तारें, पौधे, यहाँ तक कि पानी की एक बूँद या रेत का एक कण भी स्थान घेरता है और इनका द्रव्यमान होता है। दूसरे शब्दों में, द्रव्य वह है जिसमें भार हो, जो आयतन ग्रहण करे, भौतिक प्रतिरोध तथा जड़ता का गुण हो और ज्ञानेन्द्रियों ( sense organs) द्वारा अनुभव किया जा सके। भारत के प्राचीन दार्शनिकों ने पदार्थ को पाँच मूल तत्वों ‘पंचतत्वा’ : वायु, पृथ्वी, अग्नि, जल और आकाश में वर्गीकृत किया। उनके अनुसार, सभी वस्तुएँ चाहे वे सजीव हों या निर्जीव, इन्हीं पाँच तत्वों से मिलकर बनी हैं।
द्रव्य के लक्षण (Characteristics of Matter)
(i) द्रव्य बहुत छोटे कणों से मिलकर बना है जो हमारी कल्पना से परे है।
(ii) कणों के बीच रिक्त स्थान होता है, जिसे अन्तरआण्विक स्थान (intermolecular space) कहते हैं।
(iii) ये कण निरन्तर गतिशील होते हैं अर्थात् इनमें गतिज ऊर्जा होती है। तापमान बढ़ने से कणों की गति तेज हो जाती है जिसके कारण कणों की गतिज ऊर्जा भी बढ़ जाती है।
(iv) ये एक दूसरे को आकर्षित करते हैं। आकर्षण बल जिसे अन्तरआण्विक बल (intermolecular force) कहते हैं इन्हें एक साथ रखने के लिए उत्तरदायी है।
(v) इस आकर्षण बल का सामर्थ्य प्रत्येक पदार्थ में अलग-अलग होता है।
द्रव्य के कण (Particles of Matter)
द्रव्य में मुख्यतया दो प्रकार के कण होते हैं
परमाणु (Atoms)
‘एटम’ शब्द ग्रीक एटोमोस (atomos) से लिया गया है जिसका अर्थ है ‘अविभाज्य’ । तत्व का वह सूक्ष्मतम कण जो स्वतन्त्र रूप से रह सकता है और नहीं भी तथा उसके सभी रासायनिक गुणधर्मों को प्रदर्शित करता है अर्थात् रासायनिक अभिक्रिया में भाग लेता है, परमाणु कहलाता है। विभिन्न तत्वों के परमाणुओं के द्रव्यमान तथा रासायनिक गुणधर्म भिन्न-भिन्न होते हैं।
अणु (Molecules)
साधारणतया अणु ऐसे दो या दो से अधिक परमाणुओं का समूह होता है जो आपस में रासायनिक आबन्ध द्वारा जुड़े होते हैं। अणु किसी तत्व अथवा यौगिक का वह सूक्ष्मतम कण है जो सामान्य दशाओं में रह सकता है। यह पदार्थ के सभी गुणधर्मों को प्रदर्शित करता है। यद्यपि यह रासायनिक अभिक्रिया में भाग नहीं लेता है।

द्रव्य की अवस्थाएँ (States of Matter)
द्रव्य अपने तीन रूप में होते हैं — ठोस, द्रव और गैस । द्रव्य की ये अवस्थाएँ इनमें उपस्थित अन्तर आण्विक बलों और अन्तरआण्विक स्थान में विभिन्नता के कारण होती हैं।
1. ठोस अवस्था (The Solid State)
द्रव्य की इस अवस्था में, पदार्थ निश्चित द्रव्यमान, आयतन और आकृति रखते हैं। उदाहरण लकड़ी, मेज, पेन, किताब, आदि। ठोसों में अवयवी कणों के बीच अन्तरआण्विक स्थान बहुत कम होते हैं लेकिन अन्तरआण्विक बल बहुत प्रबल होते हैं। इनके अवयवी कण (परमाणु, अणु अथवा आयन) गति नहीं कर सकते लेकिन ये केवल अपनी माध्य स्थितियों के चारों ओर दोलन कर सकते हैं। यही कारण है कि ठोस असम्पीड्य (incompressible) और कठोर (rigid) होते हैं (अर्थात् निश्चित आकार और आकृति रखते हैं)। प्रबल अन्तर आण्विक बलों के कारण ठोस बहुत अधिक सघन (highly densed) और उच्च गलनांक (high melting point) वाले होते हैं।
ठोसों का वर्गीकरण (Classification of Solids)
इन्हें दो वर्गों में वर्गीकृत किया गया है
(i) क्रिस्टलीय ठोस (Crystalline Solids) ये क्रिस्टलों की अत्यधिक संख्या से बने होते हैं। क्रिस्टल में अवयवी कणों का क्रम सुव्यवस्थित होता है। उदाहरण सोडियम क्लोराइड, क्वार्ट्ज (क्रिस्टलीय), डायमण्ड, ग्रेफाइट, आदि ।
(ii) अक्रिस्टलीय ठोस ( Amorphous Solids) ये असमाकृति (आकृति नहीं होना) के कणों से बने होते हैं। इनमें अवयवी कणों का व्यवस्था क्रम अनियमित होता है। उदाहरण काँच, रबड़, प्लास्टिक, आदि । अक्रिस्टलीय ठोसों को आभासी ठोस (pseudo solids) अथवा अतिशीतित द्रव (supercooled liquids) भी कहा जाता है।
2. द्रव अवस्था ( The Liquid State)
इस अवस्था में, पदार्थों की आकृति निश्चित नहीं होती लेकिन आयतन निश्चित होता है। ये जिस पात्र में रखे जाते हैं उसी की आकृति ले लेते हैं। उदाहरण जल, तेल, दूध, आदि। पात्र की आकृति कुछ भी हो सभी स्थितियों में द्रव की ऊपरी सतह सदैव समतल होती है। द्रव बहते हैं और अपनी आकृति परिवर्तित कर लेते हैं इसलिए ये कठोर नहीं होते हैं। इन्हें बहने वाला द्रव अर्थात् तरल (fluids) कहते हैं (पदार्थ जो वह सकते हों)। द्रवों में अन्तर आण्विक बल इतने प्रबल नहीं होते कि वे कणों को प्रबलता से बाँधे रख सकें यही कारण है कि ये कम सघनता से सम्पीड्य हैं। यद्यपि बल इतने पर्याप्त होते हैं कि इनके कण एक दूसरे के वातावरण से पलायन नहीं करते। अतः इनमें पर्याप्त गति होती है और इनका आयतन निश्चित होता है।
3. गैस अवस्था ( The Gaseous State)
इस अवस्था में, द्रव्य की न तो श्चित आकृति होती है और न ही आयतन। ये जिस पात्र में रखे जाते हैं उसका आकार और आयतन ले लेते हैं। उदाहरण वायु, हाइड्रोजन, ऑक्सीजन, नाइट्रोजन, आदि। गैसीय अवस्था में अन्तरआण्विक बल बहुत दुर्बल होते हैं और अणुओं के बीच अन्तरआण्विक स्थान बहुत अधिक होते हैं। यही कारण है कि ठोस और द्रवों की अपेक्षा गैसें बहुत अधिक सम्पीड्य होती हैं। गैसें जिस पात्र में रखी जाती हैं उसमें बहती हैं। अतः उन्हें भी तरल कहा जाता है।
इसके अतिरिक्त गैसें गर्म करने पर ठोस और द्रव की अपेक्षा अधिक फैलती हैं क्योंकि इनमें द्रव और ठोस की अपेक्षा अन्तर आण्विक बल दुर्बल होते हैं।
गैसीय दाब (Gaseous Pressure) गैसीय अवस्था में, कणों की गति अनियमित और अत्यधिक तीव्र होती है जिसके कारण ये कण आपस में एवं पात्र की दीवारों से भी टकराते हैं। यही कारण है। कि गैस पात्र की दीवारों पर दाब डालती है।
द्रव्य की दो और अवस्थाएँ (Two More States of Matter)
आजकल द्रव्य की दो और अवस्थाओं पर चर्चा हो रही है लेकिन ये दोनों अवस्थाएँ ताप और दाब की चरम दशाओं में ही पाई जाती हैं।
प्लाज्मा (Plasma) यह अत्यधिक ऊर्जा वाले और अधिक उत्तेजित कणों से बना होता है। इस अवस्था में कण आयनीकृत (ionised) गैस के रूप में होते हैं। फ्लोरसेंट ट्यूब और निऑन बल्ब में प्लाज्मा होता है। विद्युत प्रवाहित होने पर इनके अन्दर उपस्थित गैस आयनीकृत हो जाती है जिसके कारण बल्ब या ट्यूब में चमकीला प्लाज्मा बनता है। उच्च तापमान के कारण तारों में भी प्लाज्मा बनता है जिसके कारण इनमें चमक होती है।
बोस-आइंस्टीन कन्डेनसेट (Bose-Einstein Condensate, BEC) इस अवस्था का नाम वैज्ञानिक सत्येन्द्रनाथ बोस (भारत) और अल्बर्ट आइंस्टीन के नाम पर रखा गया। सामान्य वायु के घनत्व के एक लाखवें भाग जितने कम घनत्व वाली गैस को बहुत ही कम तापमान पर ठण्डा करने से BEC तैयार होता है। सन् 2001 में USA के ऐरिक ए. कॉर्नेल, उल्फगैंग केटरले और कार्ल ई. वेमैन ने ‘बोस-आइंस्टीन कन्डनसेशन’ की अवस्था प्राप्त करने के लिए भौतिकी में नोबेल पुरस्कार प्राप्त किया।
विसरण (Diffusion)
दो विभिन्न प्रकार के द्रव्यों के कणों के स्वतः अन्त मिश्रण (आपस में मिलने) होने की प्रक्रिया विसरण कहलाती है। उदाहरण जल में एक बूँद स्याही की डालने पर यह पूरे जल में एक समान रूप से फैल जाती है। गर्म करने पर कणों की गति तेज हो जाती है जिसके कारण अन्तरआण्विक स्थान बढ़ जाते हैं अर्थात् अन्तर आण्विक बल घट जाते हैं। इस प्रकार विसरण तेज हो जाता है। यही कारण है कि गर्मा-गरम खाने की गन्ध कई मीटर दूर से ही आपके पास पहुँच जाती है लेकिन ठण्डे खाने की महक लेने के लिए आपको उसके पास जाना पड़ता है।
ठोस, द्रव और गैस, द्रवों में विसरित हो सकते हैं। ठोसों की अपेक्षा द्रवों के विसरण की दर अधिक होती है क्योंकि द्रव अवस्था में कण मुक्त रूप से गति करते हैं और ठोसों की अपेक्षा द्रवों में अन्तरआण्विक स्थान भी अधिक होते हैं। कणों की तेज गति और अत्यधिक रिक्त स्थानों के कारण, गैसें अन्य गैसों में बहुत तीव्रता से विसरित होने का गुण दर्शाती हैं।
द्रव्य की अवस्थाओं का अन्तः परिवर्तन (Interconversion of States of Matter)
द्रव्य की अवस्थाएँ अन्तः परिवर्तित होती हैं। द्रव्य की अवस्थाओं में परिवर्तन ताप और दाब में परिवर्तन से किया जा सकता है।
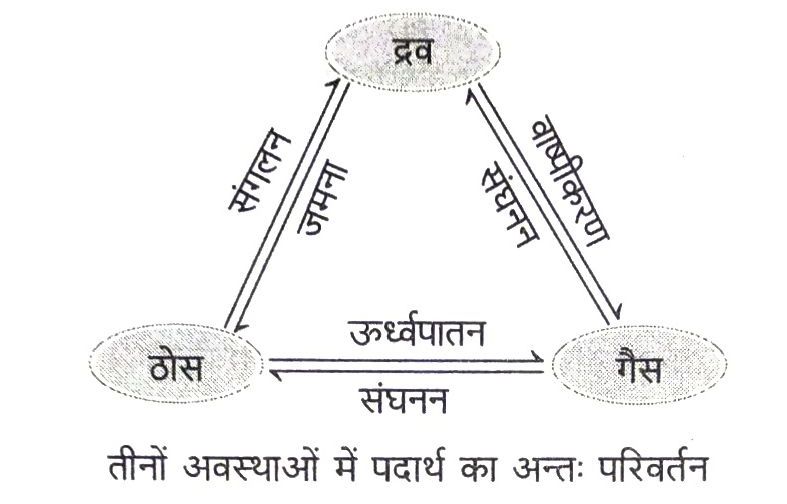
द्रव्य की अवस्थाओं के अन्तः परिवर्तन से सम्बन्धित विभिन्न परिभाषिक शब्द निम्न प्रकार हैं
(i) संगलन (Fusion) गलने की प्रक्रिया अर्थात् ठोस से द्रव अवस्था में परिवर्तन को संगलन कहते हैं।
(ii) गलनांक (Melting Point) साधारण वायुमण्डलीय दाब पर वह तापमान जिस पर ठोस पिघलकर द्रव वन जाता है, इसका गलनांक कहलाता है। किसी ठोस का गलनांक उसके कणों के बीच के आकर्षण बल के सामर्थ्य को दर्शाता है अर्थात् ठोस का गलनांक अधिक होने पर ठोस के कणों के मध्य आकर्षण बल भी अधिक होते हैं। साधारण वायुमण्डलीय दाब पर बर्फ का गलनांक 0°C होता है।
(iii) ऊर्ध्वपातन (Sublimation) यह प्रक्रिया उन ठोसों के लिए प्रयुक्त की जाती है जो गर्म करने पर द्रव अवस्था में परिवर्तित हुए बिना ठोस अवस्था से सीधे गैस तथा ठण्डा करने पर सीधे गैस से वापस ठोस में बदल जाते हैं। इस प्रकार के ठोस ऊर्ध्वपात (sublimates) कहलाते हैं।
(iv) वाष्पीकरण (Vaporisation) इस प्रक्रिया में गर्म करने पर द्रव तीव्रता से गैस में परिवर्तित होता है। क्वथनांक से कम तापमान पर द्रव के वाष्प में परिवर्तित होने की इस प्रक्रिया को वाष्पीकरण कहते हैं।
(v) क्वथनांक (Boiling Point) साधारण वायुमण्डलीय दाब पर वह तापमान जिस पर कोई द्रव उबलना शुरु होता है, इसका कवथनांक कहलाता है। क्वथनांक एक समष्टि परिघटना (bulk phenomenon) है। सामान्य ताप पर जल का क्वथनांक 100°C होता है।
(vi) संघनन (Condensation) इस प्रक्रिया में गैस द्रव अवस्था में परिवर्तित हो जाती है।
(vii) जमना (Solidification) इस प्रक्रिया में द्रव ठोस अवस्था में परिवर्तित हो जाता है।
(viii) गुप्त ऊष्मा (Latent Heat) Latent शब्द का अर्थ है छुपा हुआ । निश्चित ताप पर किसी पदार्थ के अवस्था परिवर्तन (जैसे बर्फ का जल में परिवर्तन, जल का भाप में परिवर्तन) में उत्सर्जित या अवशोषित ऊष्मा, गुप्त ऊष्मा कहलाती है। गुप्त ऊष्मा की गणना दो तरह से कर सकते हैं
संगलन की गुप्त ऊष्मा (Latent Heat of Fusion) संगलन की गुप्त ऊष्मा ऊर्जा की वह मात्रा है जो 1 किलोग्राम ठोस को वायुमण्डलीय दाब पर उसके संगलन बिन्दु पर लाने के लिए प्रयोग होती है। 0°C पर जल के कणों की ऊर्जा उसी तापमान पर बर्फ के कणों की ऊर्जा से अधिक होती है। ऐसा संगलन की गुप्त ऊष्मा की उपस्थिति के कारण होता है।
वाष्पीकरण की गुप्त ऊष्मा (Latent Heat of Vaporisation) वाष्पीकरण की गुप्त ऊष्मा ताप की वह मात्रा है जो 1 किलोग्राम द्रव को वायुमण्डलीय दाब और द्रव के क्वथनांक पर गैसीय अवस्था में परिवर्तन करने हेतु प्रयोग होती है। क्वथन के दौरान वाष्पीकरण की गुप्त ऊष्मा के कारण ताप स्थिर रहता है।
अन्तः परिवर्तन पर तापमान परिवर्तन का प्रभाव (Effect of Change of Temperature on interconversion)
ठोस को गर्म करने पर उसके कणों की गतिज ऊर्जा बढ़ जाती है जिसके कारण वे अधिक तेजी से कम्पन करने लगते हैं (अपने निश्चित स्थान पर)। ऊष्मा के द्वारा प्रदत्त (supplied) की गई ऊर्जा, कणों के बीच के आकर्षण बल को पार कर लेती है। इस कारण कण अपने नियत स्थान को छोड़कर अधिक स्वतन्त्र होकर गति करने लगते हैं तथा एक अवस्था ऐसी आती है, जब ठोस पिघलकर द्रव में परिवर्तित हो जाता है।
अन्तः परिवर्तन पर दाब परिवर्तन का प्रभाव (Effect of Change of Pressure on interconversion)
दाब बढ़ाने से और ताप घटाने से हम किसी गैस को द्रव में तथा द्रव को ठोस में परिवर्तित कर सकते हैं। इसका विपरीत हम दाब घटाकर और ताप बढ़ाकर प्राप्त कर सकते हैं।
द्रव्य का रासायनिक वर्गीकरण (Chemical Classification of Matter)
रासायनिक प्रकृति के आधार पर द्रव्य को इस प्रकार वर्गीकृत किया जा सकता है
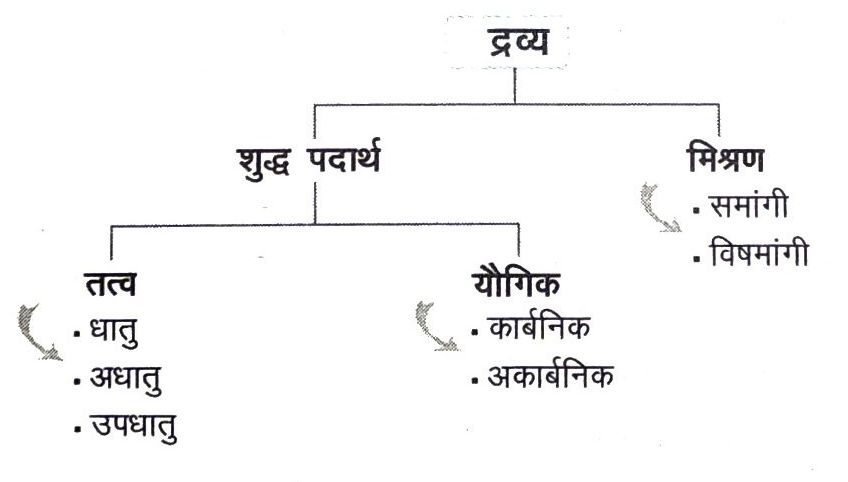
तत्व (Element)
राबर्ट बॉयल (1661) ने सर्वप्रथम तत्व शब्द का प्रयोग किया था। एण्टोनी लॉरेन्ट लेवाइजिए के अनुसार, “तत्व पदार्थ का वह मूल रूप है जिसे किसी भौतिक या रासायनिक प्रतिक्रिया द्वारा अन्य सरल पदार्थों में विभाजित नहीं किया जा सकता।” वास्तव में तत्व वह मूलभूत द्रव्य है, जो केवल एक ही प्रकार के परमाणुओं से मिलकर बना है। इलेक्ट्रॉनिक संरचना के अनुसार, तत्व वह पदार्थ (द्रव्य) है जिसके प्रत्येक परमाणु का नाभिकीय आवेश समान होता है। उदाहरण ऑक्सीजन, डायमण्ड, ग्रेफाइट, लाल फॉस्फोरस, आदि ।
तत्व ठोस जैसे ऐलुमिनियम (AI), आयरन (Fe), गोल्ड (Au), सिल्वर (Ag), आदि, द्रव जैसे मर्करी (Hg), ब्रोमीन (Br) और गैस जैसे ऑर्गन (Ar), हीलियम (He), ऑक्सीजन (O), हाइड्रोजन (H), आदि हो सकते हैं। वर्तमान समय में 118 तत्वों की खोज की जा चुकी है इनमें से 98 तत्व प्रकृति में पाए जाते हैं जबकि शेष तत्व कृत्रिम रूप से संश्लेषित किए गए हैं।
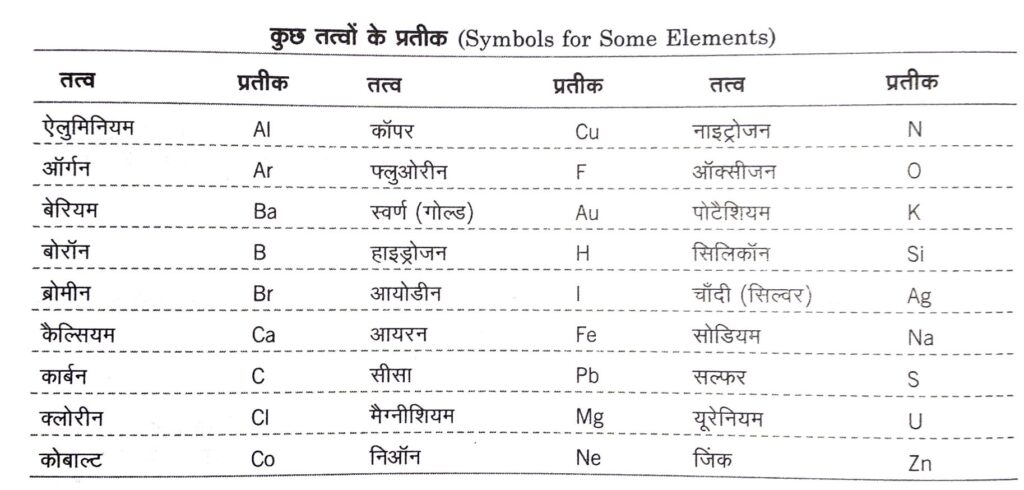
कुछ तत्वों के प्रतीकों को लैटिन, जर्मन और ग्रीक भाषाओं में उनके नामों से बनाया गया है। किसी प्रतीक के पहले अक्षर को सदैव बड़े अक्षर (capital letter) में तथा दूसरे अक्षर को छोटे अक्षर (small letter) में लिखा जाता है। तत्वों को साधारणतया धातुओं, अधातुओं और उपधातुओं में बाँटा जा सकता है। इनके गुणधर्मो का वर्णन बाद में करेंगें।
यौगिक (Compound)
यौगिक वह शुद्ध पदार्थ है जो दो या दो से अधिक तत्वों के निश्चित अनुपात में रासायनिक तौर पर संयोजन से बना है। यौगिक का संघटन हमेशा निश्चित होता है (सब जगह समान) तथा इसके भौतिक और रासायनिक गुणधर्म उसके घटक तत्वों के गुणधर्मों से भिन्न होते हैं। उदाहरण जल (H2O), मेथेन (CH4), चीनी (C12H22O11), नमक (NaCl), बेकिंग सोड़ा (NaHCO3), आदि ।
किसी यौगिक के घटकों (अवयवी तत्वों) को रासायनिक या विद्युत रासायनिक अभिक्रियाओं द्वारा पृथक् किया जा सकता है लेकिन भौतिक विधियों द्वारा नहीं। यह समांग होता है। किसी यौगिक के भौतिक और रासायनिक गुणधर्म इसके अवयवी तत्वों से भिन्न होते हैं। यौगिकों को मोटे तौर पर कार्बनिक (जिसमें कार्बन मुख्य अवयव है) तथा अकार्बनिक (जिनमें कार्बन मुख्य अवयव नहीं है) यौगिकों में वर्गीकृत किया जा सकता है।
मिश्रण (Mixture)
हमारे आस-पास उपस्थित अधिकांश पदार्थ दो या दो से अधिक शुद्ध पदार्थों (घटकों) के मिश्रण हैं। अतः मिश्रण अशुद्ध पदार्थ है तथा इनमें इनके घटकों का अनुपात निश्चित नहीं होता है। उदाहरण वायु ( विभिन्न गैसों जैसे O2, N2, CO2, आदि का मिश्रण), समुद्री जल, खनिज, मृदा, आदि सभी मिश्रण हैं।
मिश्रणों को उनके घटकों में सरल भौतिक विधियों तथा यान्त्रिक विधियों द्वारा पृथक् किया जा सकता है।
मिश्रण के प्रकार (Types of Mixture)
मिश्रण में उपस्थित घटकों की प्रकृति के आधार पर मिश्रण दो प्रकार के होते हैं
(i) समांगी मिश्रण (Homogeneous Mixture) इन मिश्रणों का संघटन सब जगह समान होता है। इस प्रकार के मिश्रणों के उदाहरण हैं जल में नमक, जल में चीनी, मेथेनॉल और जल, सिरका, टूथपेस्ट, टायलेट सोप, मृदु पेय, आदि। इन्हें वास्तविक विलयन (true solutions) भी कहा जाता है। इन विलयनों में विलेय के कणों का व्यास 1 नैनोमी से कम होता है।
(ii) विषमांगी मिश्रण (Heterogeneous Mixture ) इन मिश्रणों का संघटन पूरे मिश्रण में समान नहीं होता तथा इनमें भौतिक रूप से घटकों को स्पष्ट देखा जा सकता है। सोडियम क्लोराइड और लोहे के चूर्ण का मिश्रण, वायु में धूल के कण, नमक और सल्फर, जल और तेल, कोलॉइड (दूध) और निलम्बन (suspension) आदि विषमांगी मिश्रणों के उदाहरण हैं।
मिश्रण के अवयवों का पृथक्करण (Separating the Components of a Mixture)
विषमांगी मिश्रणों को उनके संगत घटकों में साधारण भौतिक प्रक्रिया द्वारा पृथक् किया जा सकता है जैसे हाथ से चुनकर, छन्नी से छानकर, जो हम प्रतिदिन व्यवहार में लाते हैं। कभी-कभी समांगी मिश्रण से घटकों को पृथक् करने के लिए विशेष तकनीकों को प्रयोग में लाया जाता है।
(i) वाष्पीकरण (Evaporation ) हम वाष्पशील घटक (विलायक) को इसके अवाष्पशील घटकों (विलेय) से वाष्पीकरण की प्रक्रिया द्वारा पृथक् कर सकते हैं। उदाहरण समुद्री जल से नमक की पुनः प्राप्ति। वाष्पीकरण की दर तापमान, पृष्ठीय क्षेत्रफल, वायु की गति में वृद्धि तथा आर्द्रता में कमी के साथ बढ़ जाती है।
(ii) अपकेन्द्रण (Centrifugation) इस प्रक्रिया में विषमांगी मिश्रण के अवसादन (भारी कणों का बैठना ) के लिए अपकेन्द्रीय बल (centrifugal force) का उपयोग किया जाता है। यह इस सिद्धान्त पर आधारित है, कि मिश्रण को तेजी से घुमाने पर भारी कण नीचे बैठ जाते हैं और हल्के कण ऊपर ही रह जाते हैं।
अपकेन्द्रण तकनीक का प्रयोग डेयरी और घरों में क्रीम से मक्खन अलग करने में, वाशिंग मशीन में भीगे कपड़ों से जल निचोड़ने में और अशुद्धियों को दूर करने में किया जाता है।
(iii) पृथक्कारी कीप द्वारा (By the Use of Separating Funnel) पृथक्कारी कीप की सहायता से हम दो अमिश्रणीय द्रवों के मिश्रण को पृथक् कर सकते हैं। यह इस सिद्धान्त पर आधारित है कि आपस में न मिलने वाले द्रव अपने घनत्व के अनुसार विभिन्न परतों में पृथक् हो जाते हैं।
इसका उपयोग मिट्टी के तेल और जल के मिश्रण को पृथक् करने में किया जाता है तथा धातु शोधन (extraction) के दौरान लोहे को पृथक् करने में। इस विधि के द्वारा हल्के स्लैग (धातुमल) को ऊपर से हटा लिया जाता है तथा भट्टी की निचली सतह पर पिघला हुआ लोहा शेष रह जाता है।
(iv) ऊर्ध्वपातन (Sublimation) ऊर्ध्वपातन प्रक्रिया द्वारा उन मिश्रणों, जिनमें ऊर्ध्वपातित हो सकने वाले अवयव हों, को ऊर्ध्वपातित न होने योग्य अशुद्धियों से पृथक् किया जाता है। इस विधि में मिश्रण को गर्म किया जाता है जिससे ऊर्ध्वपातनीय पदार्थ की वाष्प बनती हैं जिन्हें एकत्रित करके ठण्डा करने पर शुद्ध ठोस पदार्थ प्राप्त करते हैं। इस तकनीक के द्वारा ऊर्ध्वपातनीय यौगिकों जैसे नैफ्थेलीन, ऐन्थ्रासीन, कपूर, बेंजोइक अम्ल, अमोनियम क्लोराइड, मक्यूरिक क्लोराइड, शुष्क बर्फ, सैलिसिलिक अम्ल, आयोडीन, आदि का पृथक्करण विशुद्ध यौगिकों (जो ऊर्ध्वपातनीय नहीं होते) से किया जाता है।
(v) वर्णलेखन (Chromatography) क्रोमेटोग्रैफी शब्द ग्रीक शब्द ‘क्रोमा’ (chroma) से बना है जिसका अर्थ है ‘रंग’ यह कार्बनिक यौगिकों के शोधन और पृथक्करण की आधुनिक तकनीक है। यह उन मिश्रणों के अवयवों को पृथक् करने में उपयोगी है जिनकी अधिशोषण क्षमता (adsorption capacity) भिन्न होती हैं। इस तकनीक की खोज Tswett ने की थी। यह उन विलेय पदार्थों के लिए उपयोगी है जो एक ही विलायक में घुलनशील हैं। इस तकनीक का प्रयोग डाई में रंगों को पृथक् करने में, प्राकृतिक रंगों से पिगमेन्ट को पृथक् करने में तथा रक्त से नशीले पदार्थों को पृथक् करने में किया जाता है।
(vi) आसवन (Distillation) इस विधि का उपयोग उन मिश्रणों को पृथक् करने में किया जाता है जो विघटित हुए बिना उबलते हैं तथा जिनके घटकों के क्वथनांकों के मध्य अधिक अन्तराल होता है। उबालने पर, कम क्वथनांक वाले द्रव की वाष्प पहले बनती है। इसे संघनित्र से ठण्डा करके अलग एकत्रित कर लेते हैं। उच्च क्वथनांक वाले घटक की वाष्प बाद में बनती हैं। इस विधि द्वारा क्लोरोफॉर्म और ऐनिलीन; ऐसीटोन और जल पृथक् किए जाते हैं। इस विधि में दो विपरीत प्रक्रम वाष्पीकरण तथा संघनन सम्मिलित हैं क्योंकि पहले द्रव वाष्पित होता है इसके बाद वाष्पों को संघनित कर पुनः द्रव प्राप्त करते हैं।
पृथक्करण में निम्न आसवन विधियाँ प्रयोग में लाई जाती हैं
प्रभाजी आसवन (Fractional Distillation) दो या दो से अधिक घुलनशील द्रवों, जिनके क्वथनांकों में अन्तर 25 K से कम हो, के मिश्रण को पृथक् करने के लिए प्रभाजी आसवन विधि का प्रयोग किया जाता है। इसका उपकरण साधारण आसवन विधि के समान ही होता है। केवल आसवन फ्लास्क और संघनक के बीच एक प्रभाजी स्तम्भ का प्रयोग किया जाता है।
उदाहरण मेथेनॉल और ऐसीटोन के मिश्रण का पृथक्करण, वायु से विभिन्न गैसों का पृथक्करण तथा पेट्रोलियम उत्पादों से उनके विभिन्न घटकों जैसे पैट्रोल, डीजल, आदि का पृथक्करण इस विधि द्वारा किया जाता है।
निम्न दाब पर आसवन (Distillation under Reduced Pressure) इस विधि का उपयोग ऐसे द्रवों के पृथक्करण या शोधन में किया जाता है जिनके क्वथनांक उच्च होते हैं अथवा जो अपने क्वथनांक या उससे भी कम तापमान पर अपघटित हो जाते हैं। ग्लिसरॉल अपने क्वथनांक से काफी कम ताप पर अपघटित हो जाती है। अतः ग्लिसरॉल इस विधि द्वारा शोधित की जाती है तथा सोप इण्डस्ट्रीज में स्पेंट-लाई से ग्लिसरॉल का पृथक्करण किया जाता है।
भाप आसवन (Steam Distillation) इस विधि का उपयोग उन पदार्थों के शोधन और पृथक्करण में किया जाता है जो भाप के साथ वाष्पशील हों परन्तु जल में अमिश्रणीय हों। इस विधि में मिश्रण में भाप को प्रवाहित किया जाता है। शुद्ध कार्बनिक यौगिक (जो कि भाप के साथ वाष्पशील होता है) भाप के साथ बाहर आ जाता है जिसे ठण्डा करके एकत्रित कर लिया जाता है।
पृथक्कारी कीप का उपयोग करके कार्बनिक यौगिक को जल से अलग कर लेते हैं। ऑर्थों और पैरा नाइट्रोफिनॉल (अवाष्पशील) के मिश्रण को इस विधि द्वारा पृथक् किया जाता है। ऐनिलीन, चन्दन का तेल, तारपीन का तेल तथा यूकेलिप्टस का तेल, आदि का निष्कर्षण और शोधन इस विधि द्वारा किया जाता है।
(vii) क्रिस्टलीकरण (Crystallisation) यह ठोसों के शोधन की प्रायः प्रयुक्त विधि है। इस विधि में क्रिस्टल के रूप में शुद्ध ठोस को विलयन से पृथक् किया जाता है। इस विधि में शोधन किए जाने वाले पदार्थ को उचित विलायक में घोलते हैं तथा विलयन को गर्म करने पर शुद्ध पदार्थ क्रिस्टल के रूप में अलग हो जाता है और अशुद्धियाँ विलयन, जिसे मातृ द्रव (mother liquor) कहते हैं, में रह जाती हैं। क्रिस्टलों को छानकर, सुखाकर अलग कर लिया जाता है। इस तकनीक का उपयोग समुद्री जल से प्राप्त नमक के शोधन में तथा अशुद्ध नमूने से फिटकरी के क्रिस्टल प्राप्त करने में किया जाता है।
द्रव्य से सम्बन्धित द्रव्यमान परिभाषिक शब्द (Mass Terms Related to Matter)
परमाणु द्रव्यमान (Atomic Mass )
किसी तत्व का परमाणु द्रव्यमान कार्बन-12 के एक परमाणु के सापेक्ष व्यक्त किया जाता है। इसे परमाणु-द्रव्यमान मात्रक [atomic mass unit (amu)] में प्रदर्शित करते हैं। कार्बन-12 के एक परमाणु के द्रव्यमान के 12वें भाग को परमाणु द्रव्यमान मात्रक कहते हैं। आजकल amu के स्थान पर u का प्रयोग किया जाता है जिसे ‘एकीकृत द्रव्यमान’ (unified mass) कहा जाता है।
1 amu = 1.66056×10-24g
औसत परमाणु द्रव्यमान (Average Atomic Mass)
प्रकृति में अनेक तत्व एक से अधिक समस्थानिकों के रूप में पाए जाते हैं। सामान्यतः हम जब तत्वों के लिए परमाणु द्रव्यमानों का प्रयोग करते हैं वह वास्तव में औसत परमाणु द्रव्यमान होता है। इसका परिकलन तत्व के समस्थानिकों की उपस्थिति और उनकी आपेक्षिक बाहुल्यता को ध्यान में रखते हुए किया जाता है।
आण्विक द्रव्यमान (Molecular Mass)
किसी अणु का आण्विक द्रव्यमान उसमें उपस्थित विभिन्न तत्वों के परमाणु द्रव्यमानों का योग होता है। इसे प्रत्येक तत्व के परमाणु द्रव्यमान और उपस्थित परमाणुओं की संख्या के गुणनफलों के योग द्वारा प्राप्त किया जा सकता है।
उदाहरण
जल (H2O) का आण्विक द्रव्यमान = 2 × हाइड्रोजन का परमाणु द्रव्यमान + 1× ऑक्सीजन का परमाणु द्रव्यमान
= ( 2 x 1.008) + ( 1 x 16) = 18.02 u
सूत्र इकाई द्रव्यमान (Formula Unit Mass)
किसी पदार्थ का सूत्र इकाई द्रव्यमान यौगिक की सूत्र इकाई में उपस्थित सभी परमाणुओं के परमाणु भारों का कुल योग है।
उदाहरण
सोडियम क्लोराइड का सूत्र इकाई द्रव्यमान = सोडियम का परमाणु द्रव्यमान + क्लोरीन का परमाणु द्रव्यमान
= 23.0 u + 35.5 u = 58.5 u
तुल्यांकी भार (Equivalent Weight)
किसी पदार्थ का तुल्यांकी भार इसके अणुभार (या सूत्र इकाई द्रव्यमान) को इसकी संयोजकता (valency) से भाग देकर प्राप्त किया जा सकता है।
{तुल्यांकी भार = आण्विक द्रव्यमान (अणुभार )/संयोजकता}
भौतिक और रासायनिक परिवर्तन (Physical and Chemical Changes)
भौतिक परिवर्तन में, पदार्थ के भौतिक गुणों जैसे आकार, आमाप अर्थात् साइज, रंग और अवस्था में परिवर्तन हो जाता है। सामान्यतः यह उत्क्रमणीय (reversible) हैं अर्थात् अभिक्रिया की दशाओं को बदल कर पुनः मूल पदार्थ प्राप्त किया जा सकता है। इस प्रकार के परिवर्तन में कोई नया पदार्थ नहीं बनता है। पदार्थ का एक अवस्था से दूसरी में परिवर्तन जैसे जल का वाष्पीकरण, बर्फ का पिघलना, जल का जमना, जल का उबलना, बादलों का बनना, स्प्रिंग को खींचना, आदि भौतिक परिवर्तन के उदाहरण हैं।
वह परिवर्तन जिसमें एक अथवा एक से अधिक नए पदार्थ बनते हैं अर्थात् मूल पदार्थ का आन्तरिक आण्विक संघटन विकृत (deformed) हो जाता है, रासायनिक परिवर्तन कहलाता है। मैग्नीशियम रिबन, कोयला, लकड़ी व पत्तियों का जलना रासायनिक परिवर्तन हैं। फलों का पकना, पौधों में प्रकाश संश्लेषण का होना (CO2 और H2O का ग्लूकोस में परिवर्तन), सूर्य से प्रकाश, लोहे में जंग लगना, दही का जमना, आदि रासायनिक परिवर्तन के कुछ उदाहरण हैं। मोमबत्ती का जलना भौतिक और रासायनिक दोनों परिवर्तनों का उदाहरण है।
■ जुगनू (firefly) में प्रकाश उत्सर्जित करने के लिए विशेष अंग होते हैं। प्रकाश उत्पन्न करने की इस प्रक्रिया को bioluminescence कहते हैं।
रासायनिक संयोजन के नियम (Laws of Chemical Combinations)
तत्वों के संयोजन से यौगिकों का बनाना निम्न मूल नियमों के अन्तर्गत होता है द्रव्यमान-संरक्षण का नियम (Law of Conservation of Mass) इस नियम को आन्तोएन लेवाइजिए ने सन् 1789 में दिया था। इस नियम के अनुसार, द्रव्य न तो बनाया जा सकता है। और न ही नष्ट किया जा सकता है। किसी रासायनिक अभिक्रिया में,
{अभिक्रियकों का कुल द्रव्यमान = उत्पादों का कुल द्रव्यमान}
स्थिर अनुपात का नियम (Law of Definite Proportions)
यह नियम फ्रांसीसी रसायनज्ञ जोसेफ प्राउस्ट ने 1799 में दिया था। उनके अनुसार, किसी यौगिक में तत्वों के द्रव्यमानों का अनुपात सदैव समान होता है। उदाहरण विभिन्न स्थानों से लिए गए जल के प्रत्येक नमूने में भारानुसार हाइड्रोजन तथा ऑक्सीजन का अनुपात 2 : 16 या 1: 8 है। यही कारण है कि इसे निश्चित संघटन का नियम (law of constant proportions) भी कहा जाता है।
गुणित अनुपात का नियम (Law of Multiple Proportions)
यह नियम डाल्टन द्वारा सन् 1803 में दिया गया। इस नियम के अनुसार, यदि दो तत्व संयोजित होकर एक से अधिक यौगिक बनाते हैं, तो एक तत्व के साथ दूसरे तत्व के संयुक्त होने वाले द्रव्यमान छोटे पूर्णांकों (small whole numbers) के अनुपात में होते हैं।
उदाहरण हाइड्रोजन ऑक्सीजन के साथ संयुक्त होकर जल तथा हाइड्रोजन परॉक्साइड बनाती है।
हाइड्रोजन + ऑक्सीजन → जल
2 g 16 g 18 g
हाइड्रोजन + ऑक्सीजन → हाइड्रोजन परॉक्साइड
2 g 32 g 34 g
इन यौगिकों में हाइड्रोजन के निश्चित द्रव्यमान (2 g), ऑक्सीजन के 16 g और 32 g से संयुक्त होते हैं, जो कि एक सरल अनुपात 16 : 32 या 1 : 2 में है।
गै-लुसैक का गैसीय आयतनों का नियम (Gay-Lussac’s Law of Combining Volumes)
यह नियम गै-लुसैक द्वारा सन् 1808 में दिया गया। उन्होंने पाया कि जब रासायनिक अभिक्रियाओं में गैसें संयुक्त होती हैं या बनती हैं तो उनके आयतन सरल अनुपात में होते हैं बशर्तें सभी गैसें समान ताप और दाब पर हों।
उदाहरण
हाइड्रोजन + ऑक्सीजन → जल
100 mL 50 mL 100 mL
अतः हाइड्रोजन और ऑक्सीजन के आयतन (जो आपस में संयुक्त अर्थात् 100mL और 50mL होते हैं) आपस में सरल अनुपात 2 : 1 में होते हैं।
मोल संकल्पना (Mole Concept)
किसी रासायनिक स्पीशीज की मात्रा के लिए मोल SI आधार मात्रक है। सन् 1896 में विल्हेल्म ओस्टवॉल्ड ने मोल शब्द प्रस्तावित किया था जो एक लैटिन शब्द मोल्स (moles) से व्युत्पन्न होता है जिसका अर्थ होता है ढेर (heap or pile)। सन् 1967 में SI पद्धति में रासायनिक पदार्थों की इकाई के रूप में मोल स्वीकार कर लिया गया। इसे ‘mol’ प्रतीक द्वारा दर्शाते हैं। यह रासायनिक गणनाओं में उपयोग होने वाला सबसे उपयुक्त मात्रक है। किसी पदार्थ के 1 मोल को इस प्रकार परिभाषित किया गया है

हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here