ऊष्मा, ताप तथा ऊष्मागतिकी (Heat, Temperature and Thermodynamics)
ऊष्मा, ताप तथा ऊष्मागतिकी (Heat, Temperature and Thermodynamics)
ऊष्मा, ताप तथा ऊष्मागतिकी (Heat, Temperature and Thermodynamics)
ऊष्मा (Heat)
ऊष्मा ऊर्जा का वह रूप है जिससे हम गर्मी का अनुभव करते हैं। यह वस्तु की ऊष्मीय स्थिति में परिवर्तन के लिए उत्तरदायी होती है। जब दो वस्तुओं को सम्पर्क में रखते हैं, तो ऊष्मा, उच्च ताप वाली वस्तु से निम्न ताप वाली वस्तु की ओर बहती है तथा ऊर्जा का यह स्थानान्तरण तब तक होता है जब तक दोनों वस्तुओं के ताप समान न हो जाए, ऊष्मा का मात्रक कैलोरी या जूल होता है। कार्य तथा ऊष्मा दोनों ही ऊर्जा के रूप हैं, परन्तु एक ओर जहाँ कार्य के लिए वस्तुओं के बीच तापान्तर आवश्यक नहीं होता, वहीं दूसरी ओर ऊष्मा का प्रवाह तापान्तर के द्वारा ही होता है। 1 ग्राम जल का तापमान 1°C बढ़ाने के लिए जितनी ऊष्मा की आवश्यकता होती है, उसे 1 कैलोरी ऊष्मा कहा जाता है। यह ऊष्मा का व्यावहारिक मात्रक है।
1 कैलोरी = 4.186 जूल ≈ 4.2 जूल
ताप (Temperature)
किसी वस्तु का वह गुण जो यह बताता है कि वस्तु कितनी गर्म या ठण्डी है, ताप कहलाता है। अतः ताप वह भौतिक कारक है, जो एक वस्तु से दूसरी वस्तु में ऊष्मीय ऊर्जा के प्रवाह की दिशा को निश्चित करता है। जब दो वस्तुएँ सम्पर्क में आती हैं, तो ऊष्मा का प्रवाह सदैव उच्च ताप वाली वस्तु से निम्न ताप वाली वस्तु की ओर होता है।
किसी वस्तु का ताप वस्तु में उपस्थित ऊष्मा की मात्रा तथा इसके पदार्थ की प्रकृति पर निर्भर करता है जबकि किसी वस्तु में निहित ऊष्मा उस वस्तु के द्रव्यमान व ताप पर निर्भर करती है। उदाहरण यदि गर्म चम्मच को ठण्डे पानी से भरे डिब्बे में डुबोया जाता है, तब चम्मच की ऊष्मा जल में प्रवाहित हो जाती है।
ताप का मापन (Measurement of Temperature)
किसी वस्तु के ताप को मापने में उपयोग होने वाले उपकरण को तापमापी कहते हैं। गैलिलियों ने इस तापमापी को विकसित किया तथा यह पता लगाया कि ऊष्मा पर गैसें फैलती हैं। तापमापी अनेक प्रकार के होते हैं परन्तु एक ऐसा उपकरण जिसकी काँच की नली में पारा भरा होता है, ऐसे उपकरण को मुख्य तापमापी कहते हैं जिनके द्वारा ताप मापें जाते हैं, इसका अर्थ यह है कि तापमापी पारे के विस्तार तथा संकुचन के द्वारा ताप मापता है। सामान्यतः बर्फ का हिमांक न्यूनतम नियत बिन्दु (LFP) के रूप में लिया जाता है और शुद्ध जल का क्वथनांक ( 76 सेमी पारे के स्तम्भ) के रूप में लिया जाता है।
सभी तापक्रम पैमाने बनाने के लिए दो नियत बिन्दु लिए जाते हैं। प्रथम नियत बिन्दु जल का हिमांक बिन्दु ice point) है जिसे न्यूनतम नियत बिन्दु (Lower Fixed Point या LFP) भी कहते हैं। दूसरा नियत बिन्दु जल क्वथन बिन्दु (steam point) होता है, जिसे उच्चतम नियत बिन्दु (Upper Fixed Point या UFP) भी कहते हैं।
◆ प्रयोगशाला में प्राप्त अधिकतम ताप लगभग 108 K होता है जबकि न्यूनतम सम्भव ताप 10-8 K होता है।
◆ 0 K के समीप ताप के मापने को क्रायोजनिक (cryogenics) कहते हैं। इसी प्रकार बहुत उच्च ताप के मापन का व्यवहार उत्तापमापी (pyrometry) कहलाता है
◆ मानव शरीर का ताप 310.5K (37°C = 98.4°F) होता है।
◆ ठण्डे देशों में जहाँ न्यूनतम तापमान -40°C तक चला जाता है, पारा युक्त तापमापी का प्रयोग नहीं किया जाता है, क्योंकि पारा -39°C पर ही जमने लगता है। वहाँ ऐल्कोहॉल युक्त तापमापी का प्रयोग किया जाता है, क्योंकि वह -115°C पर जमता है।
तापमान पैमाने (Temperature Scales )
तापमान मापने के लिए, दो निर्धारित बिन्दु लिए जाते हैं। उनमें से एक जल का हिमांक है, जिसे बर्फ बिन्दु (ice point) कहते हैं और दूसरा बिन्दु जल का क्वथनांक है, जिसे भाप बिन्दु (steam point) कहा जाता है।
तापक्रम पैमानों के प्रकार (Types of Temperature Scales)
तापक्रम पैमानों के प्रकार निम्नलिखित हैं
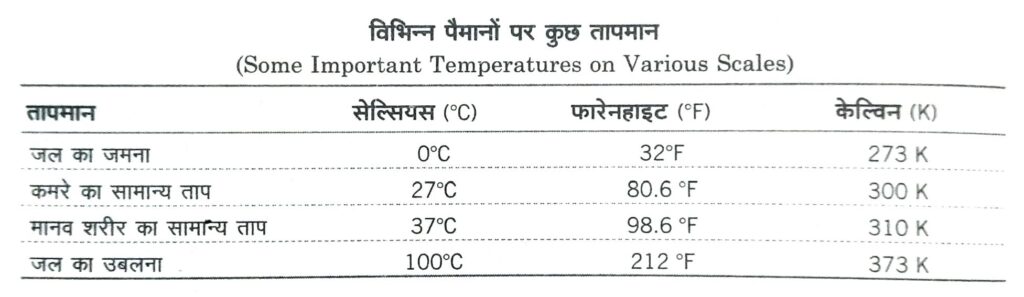
(i) सेल्सियस अथवा सेन्टीग्रेड पैमाना (Celsius or Centigrade Scale) °C इस पैमाने का आविष्कार स्वीडन निवासी सेल्सियस ने सन् 1730 ई. में किया था। इसमें हिमांक को 0°C तथा भाप बिन्दु को 100°C मानते हैं तथा इनके बीच के तापान्तराल को 100 बराबर भागों में बाँटा गया है तथा प्रत्येक भाग को 1°C कहते हैं।
(ii) फारेनहाइट पैमाना (Fahrenheit Scale) °F इस पैमाने का आविष्कार जर्मनी के फारेनहाइट नामक वैज्ञानिक ने सन् 1717 ई. में किया था। इसमें हिमांक व भाप बिन्दु को क्रमशः 32°F तथा 212°F मानकर बीच के तापान्तराल को 180 बराबर भागों में बाँटा गया है तथा प्रत्येक भाग को 1°F कहते हैं।
(iii) रियूमर पैमाना (Reaumur Scale) R इस पैमाने का आविष्कार फ्रांस के रियूमर नामक वैज्ञानिक ने सन् 1731 ई. में किया था। इसमें जल के हिमांक व भाप बिन्दु को क्रमश: 0 R व 80 R माना गया है तथा बीच की दूरी को 80 बराबर भागों में बाँटा गया है तथा प्रत्येक भाग को 1 R कहते हैं।
(iv) परम अथवा केल्विन पैमाना (Absolute or Kelvin Scale) K इस पैमाने को लार्ड कैल्विन द्वारा सन् 1852 में प्रयुक्त किया गया था। इस पैमाने में जल का हिमांक 273.15 K ≈ 273 K होता है तथा भाप बिन्दु 373.15 K ~373 K माना गया है। इनके बीच की दूरी को 100 बराबर भागों में बाँटा गया है तथा प्रत्येक भाग 1 K का निर्दिष्ट करता है।
(v) रेंकाइन पैमाना (Rankine Scale) इस पैमाने में हिमांक तथा भाप बिन्दु को क्रमशः 460 Ra व 672 Ra माना गया है। 1 Ra, दो बिन्दुओं के बीच 212 वें भाग के अन्तर के बराबर होता है।
◆ -40° ताप वह ताप है जिस पर फारेनहाइट व सेल्सियस पैमानों के पाठ्यांक समान होते हैं।
◆ 574.25° ताप पर फारेनहाइट व केल्विन पैमानों के पाठ्यांक समान होते हैं।
◆ -25.6° ताप पर फारेनहाइट व रियूमर पैमानों के पाठ्यांक समान होते है।
◆ -0° ताप पर सेल्सियस व रियूमर पैमानों के पाठ्यांक समान होते हैं।
किसी भी वस्तु का ताप-273.15°C से कम नहीं हो सकता है जिसे परम शून्य ताप कहते हैं और केल्विन पैमाने पर 0 K लिखते हैं। इस ताप पर आण्विक ऊर्जा न्यूनतम होती है।
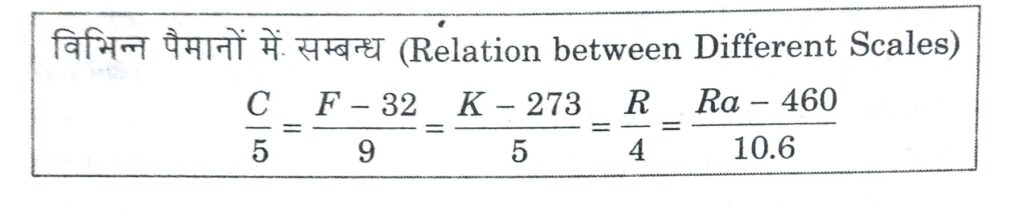
तापमापी के प्रकार (Types of Thermometer)
तापमापी मुख्यतः दो प्रकार के होते हैं, जो निम्न हैं
(i) डॉक्टरी तापमापी (Clinical Thermometer) इसके द्वारा मनुष्य के शरीर का ताप शीघ्रतापूर्वक एवं सरलता से मापा जाता है। सामान्यतः स्वस्थ मनुष्य के शरीर का ताप 98.4°F या 37°C होता है। इस पर 96°F से 110°F तक चिह्न बने होते हैं। इस तापमापी में बल्ब के ऊपर का लोड संकरा होता है, इसे मनुष्यों के मुँह में रखने पर इसमें जीभ के नीचे ताप बढ़ते समय पारा ऊपर चढ़ता है, परन्तु मुँह से निकालने के बाद ताप गिरने पर पारा तुरन्त नीचे नहीं गिरता है। जिससे शरीर का ताप शुद्धतापूर्वक ज्ञात हो जाता है तथा तापमापी को झटका देने पर ही पारा नीचे आता है।
एक डॉक्टरी तापमापी को गर्म पानी द्वारा कीटाणुरहित नही करना चाहिए, अन्यथा पारा बहुत ज्यादा फैल जाएगा और तापमापी का काँच टूट जाएगा।
(ii) विद्युत तापमापी (Electric Thermometer) विद्युत तापमापी विशेष रूप से किसी पूर्ण चालक का प्रतिरोध ज्ञात करने के लिए बनाया गया है, जोकि चालक के ताप पर निर्भर करता है। इस तापमापी के मुख्य घटक चालक के ताप परिवर्तन के कारण इसके प्रतिरोध में परिवर्तन कर देते हैं। विद्युत तापमापी में एक विद्युत परिपथ के द्वारा प्रतिरोध को मापा जाता है, जो इसे ताप में परिवर्तित करके अंकों में दिखा देता है।
आर्द्रता (Humidity)
वायुमण्डल में जलवाष्प की उपस्थिति को ही आर्द्रता कहते हैं, जलवाष्प वातावरण से 10 किमी नीचे सान्द्रित होता है तथा भौतिकी की वह शाखा जिसमें वायुमण्डल में विद्यमान जलवाष्प की मात्रा का अध्ययन किया जाता है, आर्द्रतामिति (hygrometry) कहलाती है।
वायु में उपस्थित जलवाष्प की यह मात्रा प्रत्येक स्थान पर समान नहीं होती है। प्रायः समुद्रतटीय स्थान में जलवाष्प की मात्रा अर्थात् आर्द्रता अधिक होती है। वर्षा ऋतु में भी आर्द्रता बढ़ जाती है।
निरपेक्ष आर्द्रता (Absolute Humidity)
हवा के प्रति इकाई आयतन में विद्यमान जलवाष्प की मात्रा को निरपेक्ष आर्द्रता कहते हैं। इसको अधिकतर ग्राम प्रति घन मीटर में व्यक्त करते हैं, क्योंकि तापमान और वायुदाब में परिवर्तन के साथ ही हवा के आयतन में भी परिवर्तन होता रहता है इसलिए निरपेक्ष आर्द्रता भी बदल जाती है।
आपेक्षिक आर्द्रता (Relative Humidity)
किसी दिए हुए ताप पर, वायु के किसी आयतन में उपस्थित जलवाष्प की मात्रा तथा उसी ताप पर उसी आयतन की वायु को संतृप्त करने के लिए आवश्यक जलवाष्प की मात्रा के अनुपात को आपेक्षिक आर्द्रता कहते हैं। इस अनुपात को 100 से गुणा करके आपेक्षिक आर्द्रता को प्रतिशत आर्द्रता में व्यक्त किया जाता है।
◆ आपेक्षिक आर्द्रता का मान जब अधिक होता है, तो वाष्पन की क्रिया धीमी होती है तथा नमी की अनुभूति होती है।
◆ आपेक्षिक आर्द्रता का मान जब कम होता है, तो वाष्पन की क्रिया अधिक होती है और सूखेपन की अनुभूति होती है।
◆ आपेक्षिक आर्द्रता का बहुत अधिक बढ़ जाना वर्षा का सूचक है।
◆ किसी दिये गये ताप पर वायु जलवाष्प की एक निश्चित मात्रा ही ग्रहण कर सकती है, इस अवस्था को वायु की संतृप्त अवस्था (saturated air) कहते हैं।
◆ वायु की आर्द्रता क्षमता ताप के समानुपाती होती है अर्थात् वायु की आर्द्रता क्षमता बढ़ने के साथ ताप भी बढ़ जाता है।
ऊष्मीय प्रसार (Thermal Expansion)
जब किसी पदार्थ को गर्म किया जाता है तो उसका ताप बढ़ने से उसके अनेक भौतिक गुणों में परिवर्तन हो जाता है। इनमें से एक महत्त्वपूर्ण प्रभाव पदार्थ के आकार (जैसे लम्बाई, चौडाई तथा ऊँचाई) में वृद्धि हो जाना है। इसी को पदार्थ का ऊष्मीय प्रसार कहते हैं। यह प्रसार ठोसों में सबसे कम तथा गैसों में सर्वाधिक होता है।
ठोसों का ऊष्मीय प्रसार ( Thermal Expansion of Solids)
ठोसों का ऊष्मीय प्रसार निम्न तीन प्रकार से होता है


गैसों में ऊष्मीय प्रसार (Thermal Expansion in Gases)
गैसों का कोई निश्चित आकार नहीं होता है अतः इन्हें गर्म करने पर केवल आयतन प्रसार होता है। ताप वृद्धि करने पर गैसों में आयतन प्रसार ठोसों तथा द्रवों की अपेक्षा अधिक होता है, परन्तु समान तापान्तर के लिए विभिन्न गैसों के आयतन में प्रसार समान होता है।
जल का असामान्य प्रसार (Anomalous Expansion of Water)
सामान्यतः ताप बढ़ाने पर द्रव का आयतन बढ़ता है और घनत्व घटता है तथा इसका आयतन प्रसार गुणांक, ठोस की तुलना में 10 गुना बड़ा होता है। जल इस नियम का एक अपवाद (exception) है। O°C से 4°C तक जल का आयतन घटता है तथा 4°C से ऊपर ताप में वृद्धि करने पर जल का आयतन बढ़ता है। अतः जल का घनत्व 4°C पर अधिकतम 1000 किग्रा मी-3 होता है। इस प्रकार O°C से 4°C तक जल का असामान्य प्रसार होता है, जबकि 4°C से ऊपर के तापों पर इसका प्रसार सामान्य होता है।
ठण्डी झीलों के नीचे जीवन (Life Below the Freezed Lake)
ठण्डे देशों में शीतकाल में वायु का ताप O°C से भी कम हो जाता है। अत: वहाँ की झीलों में जल जमने लगता है। वायु का ताप गिरने पर पहले झीलों की सतह का जल ठण्डा होता है। इसके बाद यह जल भारी होकर नीचे बैठता रहता है और नीचे का हल्का जल ऊपर आने लगता है। यह प्रक्रिया तब तक चलती रहती है जब तक कि पूरी झील का पानी 4°C तक नहीं गिर जाता है। जब सतह के जल का ताप 4°C से नीचे गिरने लगता है तो इसका घनत्व कम होने लगता है। अतः यह तब तक नीचे नहीं जाता है तथा O°C तक ठण्डा होकर बर्फ के रूप में सतह पर ही जमने लगता है। इस प्रकार बर्फ जमने की प्रक्रिया ऊपर से नीचे की ओर होती है। बर्फ की इस परत के नीचे अब भी 4°C का जल रहता है। चूँकि बर्फ ऊष्मा का कुचालक है। अतः वह नीचे के 4°C वाले जल की ऊष्मा को बाहर नहीं जाने देता है। इस प्रकार जल का ताप 4°C ही बना रहता है और इसमें मछलियाँ जीवित रहती हैं।

जल तुल्यांक (Water Equivalent)
किसी वस्तु का जल तुल्यांक जल का वह द्रव्यमान है, जो उतने परिमाण की ऊष्मा अवशोषित या निष्कासित करता है, जो समान ताप की वृद्धि या कमी के लिए किसी वस्तु के द्वारा अवशोषित या निष्कासित की जाती है। इसे 5 से प्रदर्शित करते हैं।
∴ (वस्तु का जल तुल्यांक, w = m x s)
इसका मात्रक किग्रा है।
अतः वस्तु का जल तुल्यांक, वस्तु के द्रव्यमान तथा विशिष्ट ऊष्मा धारिता के गुणनफल के बराबर होता है।
कैलोरीमिति का सिद्धान्त (Principle of Calorimetry)
कैलोरीमिति द्वारा पदार्थ की विशिष्ट ऊष्मा को ज्ञात किया जाता है, इसमें कैलोरीमीटर का उपयोग किया जाता हैइस नियमानुसार, जब दो भिन्न-भिन्न ताप की वस्तुओं (जिसमें एक ठोस एवं एक द्रव या दोनों द्रव) को आपस में मिलाया जाता है तो अधिक ताप वाली वस्तु से कम ताप वाली वस्तु में ऊष्मा का स्थानान्तरण तब तक होता है, जब तक कि दोनों वस्तुओं का तापमान समान न हो जाये । इस प्रक्रिया में अधिक ताप पर स्थित वस्तु के द्वारा दी गयी ऊष्मा कम ताप पर स्थित वस्तु द्वारा ली गई ऊष्मा के ठीक बराबर होती है।
∴ (गर्म वस्तु द्वारा दी गई ऊष्मा = ठण्डी वस्तु द्वारा ली गई ऊष्मा)
इस प्रकार कैलोरीमिति का सिद्धान्त ऊष्मीय ऊर्जा के संरक्षण पर आधारित है।
ऊष्मा संचरण (Transmission of Heat)
किसी एक वस्तु से दूसरी वस्तु में अथवा एक ही वस्तु में एक स्थान से दूसरे स्थान तक तापान्तर के कारण ऊर्जा संचरण की क्रिया को ऊष्मा का संचरण कहते हैं । ऊष्मा संचरण की मुख्यतः तीन विधियाँ निम्नलिखित हैं
1. चालन (Conduction )
वस्तु के विभिन्न भागों में तापान्तर के कारण, वस्तु के ऊँचे ताप वाले कण अपेक्षाकृत कम ताप वाले कणों को परस्पर सम्पर्क से (आण्विक कम्पन द्वारा) ऊष्मा देते हैं। अतः ऊष्मा के संचरण की इस प्रक्रिया को, जिसमें वस्तु के कण अपने स्थान से नहीं हटते, चालन कहते हैं।
चालन विधि द्वारा ऊष्मा का संचरण मुख्यतः ठोसों में होता है, परन्तु जब द्रव या गैस को ऊपर से गर्म करते हैं, तब उनमें ऊष्मा का संचरण ऊपर से नीचे की ओर चालन विधि द्वारा होता है। उदाहरण जब धात्विक छड़ के एक सिरे को गर्म किया जाता है, तो इसका दूसरा सिरा भी गर्म हो जाता है।
2. संवहन (Convection)
साधारणतया द्रवों तथा गैसों में ऊष्मा का संचरण संवहन प्रक्रम द्वारा होता है, इसमें पदार्थ को गर्म करने पर कणों के पूर्णतः स्थानान्तरण से धारा बहती हैं, जिन्हें संवहन धाराएँ कहते हैं।
संवहन के उपयोग (Applications of Convection)
संवहन के विभिन्न उपयोग निम्न प्रकार हैं
(i) समुद्र समीर (Sea Breeze) ऐसा देखा जाता है कि दिन में सूर्य की गर्मी से बड़े जलाशयों की तुलना में थल शीघ्र तप्त हो जाता है। तप्त थल के सम्पर्क वाली वायु तप्त होकर फैलती है तथा ऊपर उठती है। उसके रिक्त स्थान को भरने के लिए परिवेश की शीतल वायु गति करती है जिससे बड़े जलाशयों के आस-पास समुद्र समीर उत्पन्न हो जाती है। इस प्रकार एक तापीय संवहन-चक्र बन जाता है, जिसमें ठंडी वायु नीचे आती है तथा तप्त वायु ऊष्मीय स्थल से दूर स्थानान्तरित हो जाती है।
रात्रि में यह चक्र उत्क्रमित हो जाता है, क्योंकि रात्रि में थल से ऊष्मा का ह्रास अधिक शीघ्रता से होता है और जलीय-पृष्ठ, थल की अपेक्षा गर्म रहता है।
(ii) व्यापारिक पवनें (Trade Winds) पृथ्वी पर उत्तर-पूर्व से विषुवत् भाग की ओर बहने वाली पृष्ठीय पवनें, व्यापारिक पवनें कहलाती हैं। इनके बहने की व्याख्या प्राकृतिक संवहन के द्वारा दी जाती है। दिन के समय में पृथ्वी के विषुवतीय क्षेत्रों में सूर्य की ऊष्मीय ऊर्जा ध्रुवीय क्षेत्रों से अधिक प्राप्त होती है। इस कारण विषुवतीय क्षेत्रों में पृथ्वी के पृष्ठ के समीप की वायु तप्त होने से हल्की होकर ऊपर उठती है तथा ध्रुवों की ओर गतिमान होती है। इस प्रकार संवहन धाराएँ विषुवत् से ध्रुवों की ओर प्रवाहित होने लगती हैं। ध्रुवों की ठण्डी हवा विषुवत् भाग की ओर गति करती है, परन्तु पृथ्वी की घूर्णन गति इस संवहन धारा का संशोधन कर देती है जिसके कारण विषुवतीय क्षेत्र के समीप की वायु की चाल लगभग 1600 किमी / घण्टा पूर्व की ओर होती है जबकि ध्रुवों के समीप इसकी चाल शून्य होती है।
(iii) संवातन (Ventilation) कमरों की छत के निकट संवातन बनाये जाते हैं। कमरों के संवातन में संवहन प्रक्रम एक मुख्य भाग होता है, जब आग जलायी जाती है, तो चिमनी में गर्म हवा बहती है, तब यह कमरे में उपस्थित वायु से कम सघन हो जाती है। संवातन द्वारा गर्म हवाओं का निष्कासन किया जाता है।
3. विकिरण (Radiation)
ऊष्मा संचरण की इस विधि में किसी माध्यम की आवश्यकता नहीं होती है, क्योंकि यह वैद्युत चुम्बकीय प्रकृति की होती है तथा यह ऊष्मा संचरण ठोस, द्रव, गैस के साथ-साथ निर्वात् में भी सम्भव है। सूर्य से पृथ्वी तक ऊष्मा इसी विधि द्वारा आती है। इसमें ऊष्मा संचरण सर्वाधिक गति से होता है।

न्यूटन का शीतलन नियम (Newton’s Law of Cooling)
इस नियम के अनुसार, किसी गर्म वस्तु की ऊष्मा हानि की दर वस्तु तथा उसके चारों ओर के वातावरण के तापान्तर के अनुक्रमानुपाती होती है अर्थात् तापान्तर अधिक होने पर ऊष्मा हानि की दर अधिक होगी और तापान्तर कम होने पर ऊष्मा हानि की दर कम होगी। यही कारण है कि
◆ गर्म पानी 20°C से 15°C की तुलना में 100°C से 95°C तक ठण्डा होने में कम समय लेता है।
◆ जब गर्म पानी तथा शुद्ध नल के पानी को एक प्रशीतक में रखते हैं, तब गर्म पानी के ठण्डा होने की दर नल के पानी से ज्यादा होगी।
ऊष्मीय विकिरण (Thermal Radiation)
वे विकिरण जो गर्मी की संवेदना उत्पन्न करते हैं ऊष्मीय विकिरण कहलाते हैं। ऊष्मीय विकिरण का प्रसार वस्तु के ताप तथा वस्तु की विकिरण सतह की प्रकृति पर निर्भर करता है। यह वैद्युत चुम्बकीय स्पेक्ट्रम के अवरक्त क्षेत्र से सम्बन्धित होता है, इसलिए ये विकिरण अवरक्त विकिरण भी कहलाती हैं।
परावर्तन, अवशोषण तथा पारगमन क्षमता (Reflection, Absorption and Transmition )
किसी पृष्ठ द्वारा किसी समयान्तराल में परावर्तित विकिरण ऊर्जा की मात्रा तथा उसी समयान्तराल में उस पृष्ठ पर आपतित कुल विकिरण ऊर्जा की मात्रा के अनुपात को उस पृष्ठ की परावर्तन क्षमता कहते हैं। किसी पृष्ठ द्वारा किसी समयान्तराल में अवशोषित विकिरण ऊर्जा की मात्रा तथा उसी समयान्तराल में उस पर आपतित कुल विकिरण ऊर्जा की मात्रा के अनुपात को उस पृष्ठ की अवशोषण क्षमता अथवा अवशोषण गुणांक कहते हैं।
किसी पृष्ठ द्वारा किसी समयान्तराल में पारगमित विकिरण ऊर्जा की मात्रा तथा उसी समयान्तरल में उस पृष्ठ पर आपतित कुल विकिरण की मात्रा के अनुपात को उस पृष्ठ की पारगमन क्षमता अथवा पारगमन गुणांक कहते हैं।
कृष्णिका (Perfectly Black Body)
आदर्श कृष्ण पिण्ड अथवा कृष्णिका वह वस्तु है, जो अपने पृष्ठ पर गिरने वाले सम्पूर्ण विकिरण को पूर्ण रूप से अवशोषित कर लेती है चाहे उसकी तरंगदैर्ध्य कुछ भी हो। इस प्रकार, आदर्श कृष्णिका के लिए αh = 1 होता है। व्यवहार में कोई पिण्ड पूर्ण कृष्ण पिण्ड नहीं होता। फेरी का कृष्ण पिण्ड (लगभग) आदर्श कृष्ण पिण्ड माना जाता है। यह एक गोलाकार खोखला पिण्ड होता है, जिसकी दीवारें दोहरी होती हैं तथा आन्तरिक पृष्ठ काला रहता है। इसकी सतह पर एक सूक्ष्म छिद्र होता है। छिद्र पर आपतित सभी विकिरण इस पिण्ड द्वारा अवशोषित कर लिए जाते हैं यदि इसे गर्म किया जाए, तो यह सभी सम्भव तरंगदैर्ध्या को उत्सर्जित करता है।
प्लेटिनम ब्लैक या लैम्प ब्लैक को पूर्ण कृष्ण वस्तु के समकक्ष माना जा सकता है। ये पदार्थ आपतित विकिरणों का लगभग 96% से 98% तक अवशोषण कर लेते हैं।

2. ऊष्मागतिकी का प्रथम नियम (First Law of Thermodynamics)
इसके अनुसार, किसी निकाय को दी गई ऊष्मा (ΔQ) परिवेश के विरुद्ध निकाय के द्वारा किए गए कार्य (ΔW) और आन्तरिक ऊर्जा (ΔU) में वृद्धि के योग के बराबर होती है। इसे ऊर्जा संरक्षण का नियम भी कहते हैं।
ΔQ = ΔU + ΔW
जहाँ ΔQ= निकाय को प्रदान की गई ऊष्मा की मात्रा
ΔW = निकाय द्वारा किये गये कार्य की मात्रा
तथा ΔU = निकाय के आन्तरिक ऊर्जा में परिवर्तन ।
यह नियम कार्य और ऊष्मा के बीच में कोई अन्तर नहीं बताता है। यह नियम नहीं बताता है कि सम्पूर्ण ऊष्मा ऊर्जा, यांत्रिक कार्य में सतत् परिवर्तित क्यों नहीं हो सकती है।
ऊष्मागतिकी का प्रथम नियम ऊर्जा संरक्षण के सिद्धान्त पर आधारित है।
3. ऊष्मागतिकी का द्वितीय नियम (Second Law of Thermodynamics)
इस नियम को मुख्यतः निम्न कथनों द्वारा व्यक्त किया जाता है
(i) केल्विन – प्लांक का कथन इसके अनुसार, ‘किसी भी ऐसे ऊष्मा इन्जन का निर्माण असम्भव है, जो चक्रीय प्रक्रम में किसी स्रोत से ऊष्मा लेकर कार्यकारी पदार्थ में बिना कुछ परिवर्तन किए उसे पूर्णतः कार्य में बदल सके, दूसरे शब्दों में, ऊष्मा इन्जन में ऊष्मा को पूर्ण रूप से कार्य में नहीं बदला जा सकता है। इस प्रकार के इन्जन की दक्षंता सदैव 1 से कम होती है। इस कथन पर एयर कंडीशन (air condition) आधारित है।
(ii) क्लॉसियस का कथन इसके अनुसार, ‘ऐसी किसी भी स्वचालित मशीन का निर्माण असम्भव है, जो चक्रीय प्रक्रम में बिना किसी बाह्य ऊर्जा स्रोत की सहायता से ऊष्मा को ठण्डी वस्तु से गर्म तक पहुँचा सके।’ ऊष्मा सदैव गर्म वस्तु से ठण्डी वस्तु की ओर प्रवाहित होती है। प्रशीतक (refrigerator) का कार्य सिद्धान्त इस कथन पर आधारित है।
कुछ ऊष्मागतिक प्रक्रियाएँ (Some Thermodynamic Processes)
कुछ ऊष्मागतिकी प्रक्रियाएँ निम्न प्रकार हैं
(i) चक्रीय प्रक्रम (Cyclic Process) यदि किसी प्रक्रिया के दौरान निकाय विभिन्न अवस्थाओं से होता हुआ अपनी प्रारम्भिक स्थिति में आ जाता है, तो इस प्रकार की प्रक्रिया को चक्रीय प्रक्रम कहते हैं। चक्रीय प्रक्रम में, ΔU = 0
अतः चक्रीय प्रक्रम में निकाय द्वारा अवशोषित ऊष्मा किए गए कार्य के बराबर होती है।
(ii) अर्द्ध – प्रक्रम (Quasi-static Process) वह ऊष्मागतिकी प्रक्रिया जो धीरे-धीरे होती है, अर्द्ध-प्रक्रम कहलाता है। यह प्रक्रिया व्यावहारिक रूप मे संभव नहीं होती है।
(iii) परिवर्तनीय और अपरिवर्तनीय प्रक्रम (Reversible and Irreversible Process ) वह प्रक्रिया जो प्रत्यक्ष रूप से की जाती है तथा जो प्रतिलोम दिशा में दोहरायी जाती है और प्रक्रिया में भाग लेते हुए वस्तु में कोई परिवर्तन नहीं होता है, परिवर्तनीय प्रक्रम कहलाता है। इसके विपरीत, वह प्रक्रिया जो परिवर्तनीय नहीं होती है, अपरिवर्तनीय प्रक्रम कहलाता है।
(iv) विलगित निकाय (Isolated System) ऐसा निकाय जो न तो कार्य कर सकता है और न ही बाह्य वातावरण से ऊष्मा का आदान-प्रदान कर सकता है, विलगित निकाय कहलाता है। विलगित निकाय के लिए,
Q = W = 0
अतः विलगित निकाय में आन्तरिक ऊर्जा नियत रहती है। अर्थात् ΔV = नियतांक।
(v) समतापी प्रक्रम (Isothermal Process) यदि किसी निकाय में कोई प्रक्रिया इस प्रकार होती है, कि प्रक्रिया के दौरान ताप स्थिर रहता है, तो इस प्रकार की प्रक्रिया को समतापी प्रक्रम कहते हैं।
अतः इस प्रक्रिया में गैस द्वारा ली गई समस्त ऊष्मा, गैस द्वारा कार्य करने में व्यय होती है।
उदाहरण पानी उबलने की प्रक्रिया समतापी प्रक्रिया है।
(vi) रुद्घोष्म प्रक्रम (Adiabatic Process) यदि किसी निकाय में कोई प्रक्रिया इस प्रकार होती है कि प्रक्रिया के दौरान निकाय व वातावरण के बीच ऊष्मा का आदान-प्रदान नहीं होता, तो वह रुद्घोष्म प्रक्रम कहलाता है।
(vii) समदाबीय प्रक्रम और समआयतनिक प्रक्रम (Isobaric Process and Isochoric Process) ऐसी प्रक्रिया जिसके दौरान दाब स्थिर रहता है, समदाबीय प्रक्रम कहलाता है जैसे भाप इन्जन के बॉयलर में जल का उबलना, भाप का बनना, जल का जमना, आदि। यदि किसी प्रक्रिया के दौरान निकाय का आयतन स्थिर रहता है तब वह समआयतनिक प्रक्रम कहलाता है। समआयतनिक प्रक्रम के लिए W = 0
अतः इस प्रक्रिया में निकाय को दी गई सम्पूर्ण ऊष्मा, निकाय की आन्तरिक ऊर्जा में वृद्धि करने में व्यय हो जाती है।
उदाहरण आदर्श गैस समआयतनिक प्रक्रम का उदाहरण है, अर्थात् आदर्श गैसों द्वारा ऊष्मा का अवशोषण होता है। जिसका उपयोग गैसों द्वारा कार्य करने में किया जाता है।
ऊष्मा इन्जन (Heat Engine)
वह युक्ति जिसके द्वारा ऊष्मा का यान्त्रिक कार्य में रूपान्तरण किया जा सकता है, ऊष्मा इन्जन कहलाती है। ऊष्मा इन्जन के मुख्य रूप से तीन भाग होते हैं
(i) ऊष्मा का स्रोत इन्जन में किसी भी प्रकार के ईंधन को जलाकर ऊष्मा प्राप्त की जा सकती है जैसे मोटर के इन्जन में पेट्रोल जलाकर तथा रेल के भाप इन्जन में कोयला जलाकर ऊष्मा प्राप्त की जा सकती है।
(ii) कार्यकारी पदार्थ ऊष्मा से यान्त्रिक कार्य प्राप्त करने के लिए पदार्थ की आवश्यकता होती है। यह पदार्थ ऊष्मा के स्रोत से ऊष्मा का अवशोषण करके यान्त्रिक कार्य करता है; जैसे मोटर व वायुयान के इंजन में कार्यकारी पदार्थ वायु होती है तथा भाप के इन्जन में कार्यकारी पदार्थ जल होता है।
(iii) संघनित्र कार्य करने के पश्चात्, कार्यकारी पदार्थ शेष ऊष्मा को एक संघनित्र को दे देता है। इस संघनित्र का ताप ऊष्मा स्रोत के ताप से बहुत कम होता है। साधारण इन्जनों में बाह्य वायुमण्डल ही संघनित्र अथवा सिंक का कार्य करता है।

ऊष्मा इन्जन के प्रकार
ऊष्मा इन्जन दो प्रकार के होते हैं
(i) बाह्य दहन इन्जन (External Combustion) इस प्रकार के इन्जन में सिलेण्डर के बाहर ईंधन जैसे कोयला अथवा लकड़ी को जलाकर पानी को भाप बनाते हैं और उस भाप को नियन्त्रित करके इन्जन के सिलेण्डर में भेजते हैं तथा उसके द्वारा कार्य किया जाता है उदाहरण भाप इन्जन एक बाह्य दहन इंजन है।
(ii) अन्त: दहन इन्जन (Internal Combustion ) इस प्रकार के इन्जन में सिलेण्डर के अन्दर ईंधन, जैसे कोई तेल, पेट्रोल अथवा गैस को जलाकर ऊष्मा उत्पन्न की जाती है और इस ऊष्मा से कार्य प्राप्त किया जाता है जैसे पेट्रोल अथवा गैस इन्जन अन्त: दहन इन्जन हैं। आजकल पेट्रोल इन्जन एक अधिक प्रचलित प्रकार का इन्जन है जिससे मोटरकार, हवाई जहाज इत्यादि चलाए जाते हैं।

हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here