आबन्धन और रासायनिक अभिक्रियाएँ (Bonding and Chemical Reactions)
आबन्धन और रासायनिक अभिक्रियाएँ (Bonding and Chemical Reactions)
आबन्धन और रासायनिक अभिक्रियाएँ (Bonding and Chemical Reactions)
रासायनिक आबन्धन (Chemical Bonding)
विभिन्न रासायनिक स्पीशीज में उनके अनेक घटकों (अणुओं, परमाणुओं तथा आयनों) को संलग्न रखने और आपसी परमाण्विक व्यवस्था व निश्चित लेकिन विशेष ज्यामितीय आकार को बनाए रखने वाले आकर्षण बल को रासायनिक आबन्ध कहते हैं। रासायनिक आबन्ध के बनने के दौरान ऊर्जा निर्मुक्त होती है अर्थात् यह एक ऊष्माक्षेपी (exothermic) प्रक्रम है जो निकाय (system) की मुक्त ऊर्जा में कमी के साथ सम्पन्न होती है।
संयोजकता (Valency)
किसी तत्व की संयोजन शक्ति (अथवा आपसी संयोजन की क्षमता) इसकी संयोजकता कहलाती है। उत्क्रष्ट गैसें, जिन्हें पहले अक्रिय गैस कहा जात था, की संयोजकता शून्य होती है। (अक्रिय गैस – हीलियम (He), निऑन (Ne), ऑर्गन (Ar), क्रिप्टॉन (Kr), जीनॉन (Xe) और रेडॉन (Rn) हैं।)
सामान्यतः ये रासायनिक आबन्धन में भाग नहीं लेते हैं क्योंकि इनके बाह्यतम कक्ष पूर्ण भरे हुए और बहुत स्थायी हैं अर्थात् इनके बाह्यतम कक्ष में आठ इलेक्ट्रॉन (अष्टक) होते हैं। (हीलियम को छोड़कर, इसके परमाणु के बाह्यतम कक्ष में दो इलेक्ट्रॉन होते हैं)।
दूसरे शब्दों में, उत्क्रष्ट गैसों की प्रवृत्ति इलेक्ट्रॉनों की साझेदारी करने, उनको ग्रहण करने या उनका त्याग करने की नहीं होती है। अतः ये स्वतन्त्र एकपरमाणुक (monoatomic) रूप में पाए जाते हैं। किसी तत्व की संयोजकता यौगिक के बनने के दौरान ग्रहण किए गए इलेक्ट्रॉनों या त्यागे गए इलेक्ट्रॉनों की संख्या के बराबर होती है।
यदि किसी परमाणु में संयोजी इलेक्ट्रॉनों की संख्या 1, 2, 3 या 4 है, तो इसकी संयोजकता = संयोजी इलेक्ट्रॉनों की संख्या ।
यदि किसी परमाणु में संयोजी इलेक्ट्रॉनों की संख्या 5, 6, 7 या 8 है, तो इसकी संयोजकता = 8 – संयोजी इलेक्ट्रॉनों की संख्या ।
उदाहरण सोडियम में (2, 8, 1) एक संयोजी इलेक्ट्रॉन है। अतः यह इस संयोजी इलेक्ट्रॉन को त्यागकर संयोजकता कक्ष में अष्टक पूर्ण कर लेता है और Na+ (2, 8) बनाता है।
रासायनिक आबन्धन का इलेक्ट्रॉनिक सिद्धान्त अष्टक नियम (Electronic Theory of Chemical Bonding: Octet Rule)
सन् 1916 में कॉसेल तथा लुईस ने परमाणु के बीच रासायनिक संयोजन के एक महत्त्वपूर्ण सिद्धान्त को विकसित किया, जिसे रासायनिक आबन्धन का इलेक्ट्रॉनिक सिद्धान्त कहा जाता है। यह उत्कृष्ट (नोबल) गैसों की अक्रियता पर आधारित था। इस सिद्धान्त के अनुसार, “परमाणुओं का संयोजन संयोजी इलेक्ट्रॉनों के एक परमाणु से दूसरे परमाणु पर स्थानान्तरण के द्वारा (खोकर या पाकर) अथवा संयोजी इलेक्ट्रॉनों के सहभाजन (sharing) के द्वारा होता है।” इस प्रक्रिया में परमाणु अपने संयोजकता कोश में अष्टक या स्थायी विन्यास, जैसे कि उत्कृष्ट गैसों के संयोजकता कोशों में होता है, प्राप्त करते हैं। यह अष्टक नियम (octet rule) कहलाता है।
आबन्धन के प्रकार (Types of Bonding)
सामान्यतः आबन्धन को दो वर्गों में बाँटा गया है
(i) रासायनिक आबन्धन (आयनिक, सहसंयोजक और उपसहसंयोजक आबन्ध)
(ii) भौतिक आबन्धन (हाइड्रोजन और वाण्डरवाल्स आबन्ध ) ।
आयनिक या विद्युत संयोजी आबन्ध (Ionic or Electrovalent Bond)
धनायन और ऋणायन के मध्य स्थिर विद्युत आकर्षण के परिणामस्वरूप बना आबन्ध विद्युत संयोजक आबन्ध कहलाता है। इलेक्ट्रॉनों का स्थानान्तरण इस प्रकार से होता है कि संयोग में भाग लेने वाला प्रत्येक तत्व पूर्ण अष्टक प्राप्त कर लेता है (H और He के सम्बन्ध में यह दो है) ।
किसी धातु परमाणु से किसी अधातु परमाणु पर इलेक्ट्रॉनों के स्थानान्तरण द्वारा बना यौगिक आयनिक या विद्युत संयोजी यौगिक (ionic or electrovalent compound) कहलाता है।
उदाहरण सोडियम तथा क्लोरीन से सोडियम क्लोराइड का बनना

(i) सोडियम के संयोजी कोश में एक इलेक्ट्रॉन है। अतः यह एक इलेक्ट्रॉन त्यागकर अक्रिय गैस निऑन जैसा इलेक्ट्रॉनिक विन्यास प्राप्त करता है और Na+ आयन बनाता है।
(ii) क्लोरीन के संयोजी कोश में सात इलेक्ट्रॉन हैं यह एक इलेक्ट्रॉन ग्रहण करके अक्रिय गैस ऑर्गन का इलेक्ट्रॉनिक विन्यास प्राप्त करता है और CI– आयन बनाता है।
(iii) Na+ और CI– आयन परस्पर स्थिर विद्युत आकर्षण बलों द्वारा बन्ध जाते हैं। MgCl2, CaO, NH4CI, NaOH, आदि आयनिक यौगिकों के अन्य उदाहरण हैं।
◆ विद्युत संयोजकता आयन (या आयनों) पर उपस्थित इकाई आवेश (आवेशों) की संख्या है। अतः उपरोक्त उदाहरण में Na तथा Cl की विद्युत संयोजकता 1 है।
आयनिक या विद्युत संयोजी यौगिकों के लक्षण (Characteristics of Ionic or Electrovalent Compounds)
(i) सामान्यतः आयनिक यौगिक क्रिस्टलीय ठोस हैं। ये निश्चित आकार के कठोर और भँगुर (brittle) प्रकृति के होते हैं, क्योंकि इनके अवयवी कणों का क्रम सुव्यवस्थित और दीर्घ परासी होता है।
(ii) इनके गलनांक और क्वथनांक प्रबल स्थिर विद्युत आकर्षण बलों के कारण बहुत अधिक होते हैं।
(iii) ये अवाष्पशील उच्च घनत्व वाले ठोस हैं।
(iv) आयनिक यौगिक अध्रुवीय विलायकों जैसे बेन्जीन, ऐसीटोन, कैरोसीन, पेट्रोल, आदि में अविलेय होते हैं। क्योंकि ये (विलायक) प्रकृति में सहसंयोजक है।
(v) ये अपनी जलीय अवस्था और गलित अवस्था में गतिमान आयनों की उपस्थिति के कारण विद्युत का संचालन करते हैं। इन अवस्थाओं में ये विद्युत अपघट्य की तरह व्यवहार करते हैं। यद्यपि ये ठोस अवस्था में विद्युत का संचालन नहीं करते हैं क्योंकि आयन प्रबल स्थिर विद्युत आकर्षण बलों द्वारा बँधे रहते हैं अर्थात् आयन गमन के लिए मुक्त नहीं होते हैं।
(vi) विलयन में आयनिक यौगिकों की अभिक्रियाएँ तीव्र गति से होती है।
◆ तापमान में वृद्धि के साथ धातुओं की चालकता घटती है जबकि आयनिक यौगिकों की चालकता बढ़ती है। ऐसा उच्च तापमान पर धातुओं के केर्नाल (kernal) के विचलित होने के कारण होता है।
सहसंयोजक आबन्ध (Covalent Bond)
दो समान परमाणुओं या लगभग समान विद्युत ऋणात्मकता वाले दो असमान परमाणुओं के मध्य इलेक्ट्रॉनों की साझेदारी से बना आबन्ध सहसंयोजक आबन्ध कहलाता है। साझेदारी इस प्रकार से होती है कि बने हुए अणु में संयुक्त होने वाले परमाणु अपने बाह्यकोश में उत्कृष्ट गैस के समान स्थायी इलेक्ट्रॉनिक विन्यास प्राप्त कर लेते हैं। यौगिक जो इलेक्ट्रॉनों की साझेदारी के परिणामस्वरूप बनते हैं सहसंयोजक यौगिक (covalent compounds) कहलाते हैं। जैसे Cl2 अणु का बनना। प्रत्येक क्लोरीन परमाणु में अष्टक विन्यास प्राप्त करने के लिए एक इलेक्ट्रॉन की कमी है। दोनों क्लोरीन परमाणु सहभाजित इलेक्ट्रॉन युग्म में एक-एक इलेक्ट्रॉन का योगदान करके अपने कोश में अष्टक विन्यास प्राप्त कर लेते हैं
एकल, द्विक और त्रिक सहसंयोजी आबन्ध (Single, Double and Triple Covalent Bonds)
जब दो परमाणुओं के मध्य एक इलेक्ट्रॉन युग्म का सहभाजन होता है तो एकल सहसंयोजी आबन्ध (single covalent bond) कहलाता है। उदाहरण

जब दो परमाणुओं के मध्य दो इलेक्ट्रॉन युग्मों का सहभाजन होता है तो उनके बीच का सहसंयोजी आबन्ध द्विक सहसंयोजी आबन्ध (double covalent bond) कहलाता है। उदाहरण

जब संयोजी परमाणुओं के मध्य तीन इलेक्ट्रॉन युग्मों का सहभाजन होता है तो उनके मध्य बना सहसंयोजी आबन्ध त्रिक सहसंयोजी आबन्ध (triple covalent bond) कहलाता है। उदाहरण

सहसंयोजकता (Covalency)
किसी सहसंयोजक यौगिक में एक परमाणु के द्वारा साझे में प्रयुक्त इलेक्ट्रॉनों की संख्या को उस तत्व की सहसंयोजकता कहते हैं। जैसे H2 अणु में, प्रत्येक हाइड्रोजन परमाणु की सहसंयोजकता 1 है। N2 अणु में प्रत्येक N – परमाणु की सहसंयोजकता 3 है, CH4 अणु में C की सहसंयोजकता 4 और प्रत्येक H की सहसंयोजकता 1 है।
सहसंयोजक यौगिकों के लक्षण (Characteristics of Covalent Compounds)
(i) सामान्यतः सहसंयोजक यौगिक गैस और द्रव हैं। इनमें कुछ नर्म ठोस हैं। डायमण्ड, सिलिका (SiO2), कार्बोरण्डम (SiC) कुछ अपवाद हैं।
(ii) इनके गलनांक और क्वथनांक अपेक्षाकृत कम होते हैं, क्योंकि इनके अणुओं के मध्य क्षीण अन्तरअणुक आकर्षण बल होते हैं।
(iii) ये जल में अविलेय हैं लेकिन अध्रुवीय विलायकों जैसे बेन्जीन, कार्बन टेट्राक्लोराइड, आदि में विलेय हैं। यद्यपि इनमें से कुछ जैसे सुक्रोस, ऐल्कोहॉल हाइड्रोजन आबन्ध बनने के कारण जल में मिश्रणीय है।
(iv) सामान्यतः सहसंयोजक यौगिक अपनी गलित अवस्था में या ठोस अवस्था में विद्युत के कुचालक हैं यद्यपि ग्रेफाइट मुक्त इलेक्ट्रॉनों की उपस्थिति के कारण विद्युत का सुचालक (conductor) है।
(v) सहसंयोजक बन्ध दृढ़ और दिशात्मक होते हैं। अतः सहसंयोजक अणुओं का आकार आकृति विशिष्ट होती है।
(vi) सहसंयोजक यौगिकों की अभिक्रियाएँ जटिल और धीमी होती हैं।
सहसंयोजी आबन्ध के प्रकार (Types of Covalent Bonds)
ध्रुवीयता के आधार पर सहसंयोजी आबन्ध दो प्रकार के होते हैं
(i) अध्रुवीय सहसंयोजी आबन्ध (Non-Polar Covalent Bond) जब सहसंयोजी आबन्ध दो समान परमाणुओं के बीच (जैसे H2, O2, Cl2, N2 या F2, आदि) बनता है, तब संयोजी इलेक्ट्रॉन युग्म दोनों परमाणुओं द्वारा समान रूप से आकर्षित होता है। इसके परिणामस्वरूप इलेक्ट्रॉन युग्म दो समान नाभिकों के ठीक मध्य में उपस्थित होता है। इस प्रकार प्राप्त आबन्ध ‘अध्रुवीय सहसंयोजी आबन्ध’ कहलाता है।
(ii) ध्रुवीय सहसंयोजी आबन्ध (Polar Covalent Bond ) विषम परमाणुक अणु (जैसे HF) में दो परमाणुओं के बीच संयोजित इलेक्ट्रॉन युग्म फ्लुओरीन की ओर विस्थापित हो जाता है, क्योंकि F की विद्युत ऋणात्मकता H की अपेक्षा अधिक होती है। इस प्रकार निर्मित आबन्ध एक ध्रुवीय सहसंयोजी आबन्ध होता है

उपसहसंयोजी आबन्ध (Coordinate Bond or Coordinate Covalent Bond or Dative Bond)
यह विशिष्ट प्रकार का सहसंयोजी आबन्ध है, जिसमें साझे के दोनों इलेक्ट्रॉन केवल किसी एक परमाणु द्वारा जाते हैं। वह परमाणु जो इलेक्ट्रॉन युग्म की आपूर्ति करता है दाता परमाणु (donor atom) कहलाता है और इलेक्ट्रॉन युग्म ग्रहण करता है वह ग्राही परमाणु (acceptor atom) कहलाता है। इस आबन्ध को तीर (सिरे को ग्राही परमाणु (acceptor atom) की तरफ रखते हुए प्रदर्शित करते हैं। उदाहरण हाइड्रोनियम आयन का बनना (formation of hydronium ion)
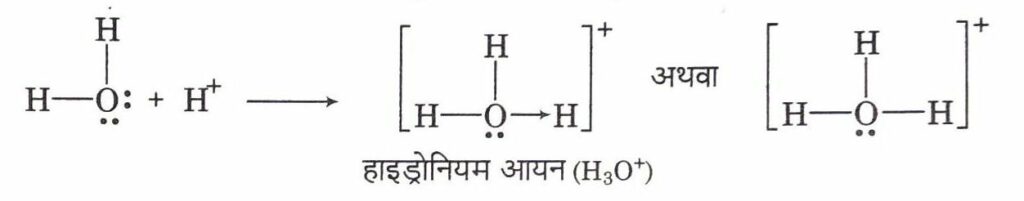
उपसहसंयोजी यौगिकों के लक्षण (Characteristics of Coordinate Compounds)
(i) ये यौगिक ठोस, द्रव तथा गैस तीनों अवस्थाओं में मिलते हैं।
(ii) इन यौगिकों के गलनांक (melting point) और क्वथनांक (boiling point) सहसंयोजी यौगिकों से उच्च लेकिन आयनिक यौगिकों की तुलना में कम होते हैं।
(iii) सहसंयोजी यौगिकों की तरह ये विद्युत के कुचालक हैं।
(iv) जल में आंशिक विलेय हैं परन्तु कार्बनिक विलायकों में शीघ्रता से विलेय हैं ।
(v) सहसंयोजी यौगिकों की तरह इनके यौगिकों की अभिक्रियाएँ मन्द गति से होती हैं।
हाइड्रोजन आबन्ध (Hydrogen Bond)
हाइड्रोजन परमाणु (जोकि पहले से ही सहसंयोजी रूप से किसी प्रबल विद्युत ऋणात्मक परमाणु जैसे N, O या F से आबन्धित है) और विद्युत ऋणात्मक परमाणु के बीच आकर्षण बलों को हाइड्रोजन आबन्ध कहते हैं। इस प्रकार, यह एक अणु के हाइड्रोजन परमाणु और दूसरे अणु के विद्युत ऋणात्मक परमाणु के बीच बनता है।
उदाहरण
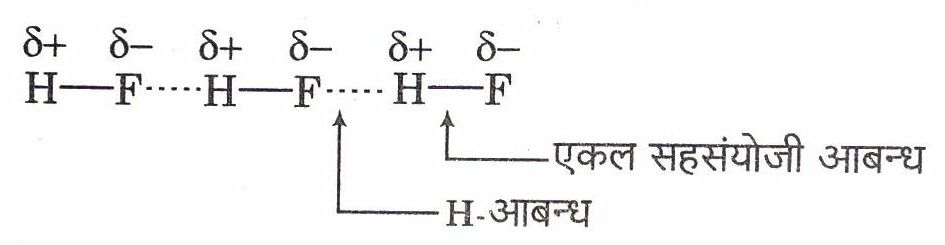
ये आबन्ध अकार्बनिक अणुओं (जैसे जल) के साथ-साथ कार्बनिक अणुओं (जैसे DNA) में भी पाए जाते हैं।
वाण्डरवाल्स बल (van der Waals’ Forces )
अणुओं के मध्य आकर्षण और प्रतिकर्षण बलों के योग को वाण्डरवाल्स बल कहते हैं। ये बल दो विपरीत आवेशित आयनों के मध्य उत्पन्न होने वाले स्थिर विद्युत बलों तथा सहसंयोजी आबन्ध में दो परमाणुओं को थामे रखने वाले बलों से भिन्न हैं। सामान्य रासायनिक आबन्धों की अपेक्षा ये बल बहुत दुर्बल होते हैं।
ये निम्न तीन प्रकार के हो सकते हैं
(i) दो स्थायी द्विध्रुवों (permanent dipoles) के मध्य बल (किसॉम बल; Keesom force) ।
(ii) स्थायी द्विध्रुव और प्रेरित द्विध्रुव (induced dipoles) के मध्य बल (डिबाई बल; Debye force)।
(iii) दो तात्क्षणिक प्रेरित द्विध्रुवों (instantaneously induced dipoles) के मध्य बल (प्रकीर्णन बल अथवा लण्डन बल; Dispersion forces or London forces)।
लण्डन बल, अधुवीय अणुओं की अन्योन्य क्रिया पर प्रभावी होते हैं।
रासायनिक सूत्र (Chemical Formula)
किसी यौगिक का रासायनिक सूत्र उसके संघटन का प्रतीकात्मक निरूपण होता है। यौगिकों के रासायनिक सूत्र लिखने के लिए तत्वों के प्रतीकों, उनकी संयोजन क्षमताओं तथा आयनों की संयोजकताओं का ज्ञात होना आवश्यक है।
यौगिकों के रासायनिक सूत्र लिखते समय पहले हम संघटक तत्वों के प्रतीक लिखकर उनकी संयोजकताएँ लिखते हैं जैसा कि नि उदाहरण में दर्शाया गया है। उदाहरण

अतः यौगिक का सूत्र (NH4)2SO4 है।
बहुपरमाणुक आयनों द्वारा निर्मित यौगिकों में आयन को पहले कोष्ठक में रखते हैं तत्पश्चात् अनुपातों को दर्शाने वाली संख्या को लिखते हैं। यदि बहुपरमाणुक आयन की संख्या 1 हो तो कोष्ठक की आवश्यकता नहीं होती। जैसे NaOH|
रासायनिक सूत्र के प्रकार (Types of Chemical Formula)
रासायनिक सूत्र को निम्न तीन वर्गों में वर्गीकृत किया गया है
(i) मूलानुपाती सूत्र (Empirical Formula) यह किसी यौगिक में उपस्थित विभिन्न परमाणुओं के सरलतम पूर्ण संख्या अनुपात को व्यक्त करता है। उदाहरण एथेन (C2H6) का मूलानुपाती सूत्र CH3 है।
(ii) अणुसूत्र (Molecular Formula) यह किसी यौगिक के अणु में उपस्थित विभिन्न प्रकार के परमाणुओं की सही संख्या को दर्शाता है।
यदि किसी यौगिक में उपस्थित विभिन्न तत्वों का द्रव्यमान प्रतिशत ज्ञात है तो इसका मूलानुपाती सूत्र ज्ञात किया जा सकता है। इसके अतिरिक्त यदि मोलर द्रव्यमान ज्ञात है तो आण्विक सूत्र प्राप्त कर सकते हैं।

रासायनिक अभिक्रिया (Chemical Reaction)
वह प्रक्रिया जिसमें पदार्थ (अभिक्रियक) अभिक्रिया करके नए यौगिक (उत्पाद) बनाते हैं, रासायनिक अभिक्रिया कहलाती है। इस प्रक्रिया में पुराने आबन्ध टूटते हैं और नए आबन्ध बनते हैं। यदि अभिक्रियकों की आबन्धन ऊर्जा उत्पादों की आबन्धन ऊर्जा से अधिक होती है तो अभिक्रिया ऊर्जा के निर्मुक्त होने के साथ सम्पन्न होती है जबकि विपरीत दशाओं में ऊर्जा का अवशोषण होता है।
रासायनिक अभिक्रिया के लक्षण (Characteristics of a Chemical Reaction)
निम्न में से किसी भी प्रेक्षण की सहायता से हम निर्धारित कर सकते हैं कि एक रासायनिक अभिक्रिया हुई है
(i) अवस्था में परिवर्तन
(ii) गैस का निकास उत्सर्जन
(iii) गन्ध में परिवर्तन
(iv) रंग में परिवर्तन
(v) तापमान में परिवर्तन
(vi) ध्वनि का उत्पन्न होना
रासायनिक समीकरण (Chemical Equation)
किसी रासायनिक अभिक्रिया का तत्वों के प्रतीकों या यौगिकों के सूत्रों की सहायता से लघु निरूपण रासायनिक समीकरण कहलाता है।
(i) पदार्थ या यौगिक जो अभिक्रिया में भाग लेते हैं अभिक्रियक (reactants) कहलाते हैं। इन्हें (अभिक्रियकों) इनके बीच योग (+) का चिन्ह लगाकर बाईं ओर (LHS) लिखा जाता है।
(ii) पदार्थ या यौगिक जो अभिक्रिया के दौरान बनते हैं उत्पाद (products) कहलाते हैं। इन्हें (उत्पादों को) इनके बीच योग (+) का चिन्ह लगाकर दाईं ओर (RHS) लिखा जाता है।
(iii) तीर का सिरा उत्पाद की ओर होता है जो अभिक्रिया की दिशा दर्शाता है। उदाहरण जिंक सल्फ्यूरिक अम्ल से अभिक्रिया करके जिंक सल्फेट और हाइड्रोजन गैस बनाता है।
Zn + H2SO4 → ZnSO4 + H2 (g)
जिंक सल्फ्यूरिक अम्ल जिंक सल्फेट हाइड्रोजन
सन्तुलित रासायनिक समीकरण लिखने के नियम (Rules for Writing a Balanced Chemical Equation)
किसी रासायनिक समीकरण को लिखने के निम्नलिखित नियम हैं
(i) अभिक्रियकों के परमाणुओं की संख्या, उत्पादों के परमाणुओं की संख्या के समान होनी चाहिए (द्रव्यमान के संरक्षण का नियम से)। उदाहरण
Fe + H2O → Fe3O4 + H2
नियम के अनुसार उपरोक्त समीकरण सही नहीं है इसे इस प्रकार सही लिखा जा सकता है।
3Fe + 4H2O → Fe3O4 + 4H2 )
(ii) अभिक्रियकों और उत्पादों की भौतिक अवस्थाओं को इनके रासायनिक सूत्रों के साथ कोष्ठक में दर्शाया जाना चाहिए। उपरोक्त समीकरण को नियम (ii) के अनुसार इस प्रकार लिखा जा सकता है।
3Fe (s) + 4H2O (g) → Fe3O4 (s) + 4H2 (g)
ऊष्मरासायनिक समीकरण (Thermochemical Equation)
वह समीकरण जिसमें अभिक्रिया के साथ ऐन्थैल्पी परिवर्तन (ऊष्मा ऊर्जा) का मान भी लिखा गया हो ऊष्मरासायनिक समीकरण कहलाती है। उदाहरण
N2 (g) + 3H2 (g). → 2NH3 + 22.5 किलोकैलोरी
आयनिक समीकरण (lonic Equation)
वह समीकरण जिसमें अभिक्रियक और उत्पादों को परमाणुओं या आयनों (धनायनों /ऋणायनों) के प्रयोग द्वारा निरूपित किया जाता है आयनिक समीकरण कहलाती है। उदाहरण
Zn + Cu2++ → Cu + Zn2+
Ca2+ + 2e– → Ca (s)
रासायनिक अभिक्रियाओं के प्रकार (Types of Chemical Reactions)
विभिन्न प्रकार की रासायनिक अभिक्रियाएँ निम्नलिखित हैं
1. संयोजन अभिक्रिया (Combination Reaction)
इन अभिक्रियाओ में दो या दो से अधिक पदार्थ संयोग करके एकल उत्पाद का निर्माण करते हैं। इस प्रकार की अभिक्रियाएँ तत्व या यौगिकों के बीच होती हैं।
उदाहरण कैल्सियम ऑक्साइड की जल के साथ अभिक्रिया द्वारा बुझे चूने का निर्माण।
CaO(s) + H2O (l) → Ca(OH)2 (aq)
क्विक लाइम बुझा चूना
संयोजन अभिक्रियाओं के दूसरे उदाहरण निम्नलिखित हैं
(i) कोयले का दहन,
C(s) + O2 (g) → CO2 (g)
(ii) H2(g) और O2(g) से जल का निर्माण
2H2(g) + O2(g) → 2H2O(l)
2. वियोजन ( अपघटन) अभिक्रिया (Decomposition Reaction)
इस अभिक्रिया में एकल अभिक्रियक टूटकर दो या दो से अधिक उत्पाद प्रदान करता है। वियोजन अभिक्रिया संयोजन अभिक्रिया के विपरीत होती है। वियोजन अभिक्रिया में अभिकारकों को तोड़ने के लिए ऊष्मा, प्रकाश या विद्युत ऊर्जा की आवश्यकता होती है। अतः ये तीन प्रकार की होती हैं



अपचायकों के उदाहरण हाइड्रोजन सल्फर डाइऑक्साइड, कार्बन मोनॉक्साइड, हाइड्रोजन सल्फाइड, कार्बन, आदि हैं। ऑक्सीकारकों के उदाहरण ऑक्सीजन, ओजोन, हाइड्रोजन परऑक्साइड, पोटैशियम परमैंगनेट, पोटैशियम डाइक्रोमेट, आदि हैं।
◆ कुछ पदार्थ जैसे-नाइट्रस अम्ल (HNO2), सल्फर डाइऑक्साइड (SO2) और सल्फ्यूरस अम्ल (H2SO3) ऑक्सीकारक तथा अपचायक दोनों की तरह कार्य करते हैं, क्योंकि इनमें नाइट्रोजन और सल्फर परमाणु अपनी मध्यवर्ती ऑक्सीकरण अवस्था में उपस्थित हैं। (HNO2 में N की ऑक्सीकरण अवस्था +3, SO2 में S की ऑक्सीकरण अवस्था + 4 तथा H2SO3 में S की ऑक्सीकरण अवस्था + 4 है।
◆ CO2 में C की ऑक्सीकरण अवस्था + 4 है जो कि अधिकतम ऑक्सीकरण अवस्था है। अतः इसका और ऑक्सीकरण सम्भव नहीं है ।
ऑक्सीकरण अवस्था और ऑक्सीकरण संख्या (Oxidation State or Oxidation Number)
संयोजकता तत्वों का प्रमुख अभिलाक्षणिक गुण है। आजकल ऑक्सीकरण अवस्था या ऑक्सीकरण संख्या, संयोजकता के स्थान पर बहुधा प्रयोग किया जाता है। वास्तविक या काल्पनिक आवेश जो एक परमाणु अपनी संयुक्त अवस्था में दर्शाता है उस परमाणु की ऑक्सीकरण अवस्था या ऑक्सीकरण संख्या कहलाती है।
ऑक्सीकरण संख्या की गणना के निम्नलिखित नियम हैं
(i) किसी परमाणु की अपनी तत्व अवस्था में ऑक्सीकरण संख्या शून्य होती है। H2 में H की, P4 में P की तथा S8 में S की ऑक्सीकरण संख्या शून्य है।
(ii) सभी यौगिकों में F की ऑक्सीकरण संख्या हमेशा -1 होती है।
(iii) ऑक्सीजन की ऑक्सीकरण संख्या यौगिकों में. -2 होती है। परॉक्साइडों

(iv) धात्विक हाइड्राइडों में H की ऑक्सीकरण संख्या – 1 है, जबकि शेष यौगिकों में इसकी ऑक्सीकरण संख्या + 1 है |
(v) किसी आयन की ऑक्सीकरण संख्या उस पर स्थित आवेश का मान है।
(vi) जटिल आयन के लिए, इसके सभी परमाणुओं की ऑक्सीकरण संख्या का योग उस आयन के आवेश के बराबर होता है।
(vii) किसी अणु में उपस्थित सभी परमाणुओं की ऑक्सीकृत संख्या का योग शून्य होता है। उदाहरण OF2 में ऑक्सीजन की ऑक्सीकरण अवस्था की इस प्रकार गणना करते हैं

हमारे दैनिक जीवन में रासायनिक अभिक्रियाओं का प्रभाव (Effects of Chemical Reactions in Our Daily Life)
फलों का किण्वन होना, मानव शरीर में आमाशय में भोजन का पचना, श्वसन, ईंधन का जलना, संक्षारण और विकृतगन्धिता, आदि हमारे दैनिक जीवन में अभिक्रियाओं के कुछ उदाहरण हैं।
संक्षारण (Corrosion )
यह पर्यावरण में उपस्थित पदार्थों की क्रिया द्वारा अनचाहे संक्षारण उत्पाद बनाकर धातु की सतह का ऑक्सीकृत होकर क्षय होने की प्रक्रिया है। दूसरे शब्दों में, वायुमण्डल में धातु को खुला छोड़ने पर इसकी सतह पर ऑक्साइड या अन्य लवणों के बनने की प्रक्रिया संक्षारण है।
इस प्रक्रिया में, धात्विक सतह जोकि वायु और नमी के सीधे सम्पर्क में होती है ऑक्सीकृत हो जाती है और ऑक्साइड तथा हाइड्रॉक्साइडों के मिश्रण बनाती है। यह प्रक्रिया लगातार चलती रहती है जब तक की धातु पूर्णतया नष्ट नहीं हो जाती।

आयरन का संक्षारण जंग लगना (rusting) कहलाता है। अशुद्धियों, H+ आयन, विद्युत अपघट्यों जैसे NaCl, गैसें जैसे CO2, SO2, NO, NO2, आदि की उपस्थिति में यह तीव्रता से होता है।
इसकी रोकथाम निम्न विधियों द्वारा की जाती है
◆ विद्युत लेपन द्वारा
◆ सतह को लेपित करके (तेल, ग्रीस, पेन्ट या वार्निश से सतह पर लेप करके)
◆ मिश्र धातु बनाकर
◆ यशद लेपन करके (लोहे और इस्पात पर जस्ते की परत चढ़ाना )
◆ ऐनोडीकरण करके (सामान्यतः ऐलुमिनियम का ऐनोड प्रयुक्त करते हैं क्योंकि इसकी सतह पर ऑक्साइड परत के बनने से यह निष्क्रिय हो जाता है)
◆ खाने के डिब्बों पर टिन की परत चढ़ाई जाती है क्योंकि जिंक आयरन से अधिक क्रियाशील है। अतः शीघ्रता से विषैले पदार्थों में परिवर्तित हो जाता है।
◆ ऐलुमिनियम की सतह पर ऐलुमिनियम ऑक्साइड की परत का बनना इसके आगे के संक्षारण को रोकता है।
◆ प्लेटिनम, गोल्ड, सिल्वर, आदि धातुओं का संक्षारण नहीं होता अतः ये उत्कृष्ट धातु (noble metals) कहलाती हैं।
किण्वन (Fermentation)
सर्वप्रथम फ्रांसीसी रसायन शास्त्री लुई पाश्चर ने सन् 1857 में किण्वन की खोज की थी। इस प्रक्रिया में, ‘टिल कार्बनिक यौगिक सूक्ष्मजीवियों जैसे यीस्ट और बैक्टीरिया द्वारा अपघटित होकर सरल यौगिकों में परिवर्तित हो जाते हैं। यह ऊष्माक्षेपी प्रक्रिया है। इस प्रक्रिया में CO2 गैस तथा अल्प मात्रा में H2 और CH4 (मेथेन) गैसें निर्मुक्त होती हैं। गैसों की उपस्थिति पदार्थों के घोल का किण्वन के परिणामस्वरूप उबलने से ज्ञात होती है।
किण्वन के उदाहरण निम्नलिखित हैं
(i) लेक्टोबेसिलि के द्वारा दूध का दही में परिवर्तित होना ।
(ii) गन्ने के रस से वाइन और सिरके का निर्माण, यीस्ट का प्रयोग करके ग्लूकोस से एथिल ऐल्कोहॉल का निर्माण करना ।
(iii) बेकिंग इण्डस्ट्रीज में ब्रेड, पेस्ट्री और केक बनाने में।
विकृतगन्धिता (Rancidity)
वसा युक्त या तैलीय खाद्य सामग्री लम्बे समय तक रखने पर उसमें उपस्थित वसा या तेल का ऑक्सीकरण हो जाता है जिसके कारण इनके स्वाद और गन्ध बदल जाते हैं। यह प्रक्रिया विकृतगन्धिता कहलाती है।
इसे निम्न विधियों द्वारा रोका जा सकता है
– वसा और तेल युक्त भोज्य पदार्थों में प्रतिऑक्सीकारक जैसे BHT (ब्यूटाइलेटिड हाइड्रॉक्सी टॉलुईन), N2 ( डाइनाइट्रोजन) मिलाकर ।
– भोज्य पदार्थों को वायुरोधी डिब्बों में बन्द करके फ्रिज या डीप फ्रीजर में रखना चाहिए ।
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here