अधातुएँ और उनके यौगिक (Non-Metals and Their Compounds)
अधातुएँ और उनके यौगिक (Non-Metals and Their Compounds)
अधातुएँ और उनके यौगिक (Non-Metals and Their Compounds)
तत्व जिनकी प्रवृत्ति इलेक्ट्रॉन ग्रहण करने की होती है तथा जो ऋणायन बनाते हैं, अधातु कहलाते हैं। ये संख्या में 22 हैं और इन्हें आधुनिक आवर्त सारणी में दाईं और रखा गया है।
अधातुओं के भौतिक गुणधर्म (Physical Properties of Non-Metals)
(i) अधातुएँ सामान्यता ठोस और गैस होती हैं। ब्रोमीन अपवाद है, यह द्रव है। 10 अधातुएँ ठोस अवस्था में तथा 11 गैस अवस्था में पाईं जाती हैं।
(ii) ये विभिन्न रंग दर्शाते हैं।
(iii) ये ताप और विद्युत के कुचालक हैं। कार्बन (ग्रेफाइट रूप) अपवाद है।
(iv) ये चमकीली अघातवर्ध्य (maleable), तन्य (ductile) तथा निनादी (sonorous) नहीं होते हैं (यद्यपि आयोडीन चमकीली है ।
(v) इनके क्वथनांक और गलनांक कम होते हैं। बोरोन और कार्बन ( डायमण्ड व ग्रेफाइट) अपवाद हैं।
अधातुओं के रासायनिक गुणधर्म (Chemical Properties of Non-Metals)
(i) ये प्रकृति में धन विद्युती होते हैं। ये इलेक्ट्रॉन ग्रहण करके ऋणायन बनाते हैं।
(ii) ये ऑक्सीजन से संयोग करके ऑक्साइड बनाते हैं तथा इनके ऑक्साइड सामान्यत: अम्लीय होते हैं। उदाहरण के लिए सल्फर ऑक्सीजन में जलकर सल्फर डाइऑक्साइड बनाती है जो जल में घुलकर सल्फ्यूरस अम्ल बनाती है।
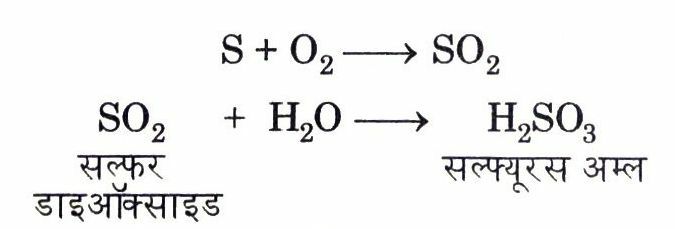
सल्फ्यूरस अम्ल नीले लिटमस पेपर को लाल कर देता है।
(iii) CO2, SO2, SO3, NO2, P2O5, आदि अधातुओं के अम्लीय ऑक्साइड हैं जबकि CO, NO, N2O और H2O अधातुओं के उदासीन ऑक्साइड है।
(iv) सामान्यतः अधातुएँ जल से क्रिया नहीं करती यद्यपि ये वायु में क्रियाशील हो सकती हैं। इस प्रकार की अधातुओं को जल में रखा जाता है। उदाहरण फॉस्फोरस क्रियाशील अधातु है यह वायु में खुला छोड़ने पर स्वत: जल जाता है। अत: इसे जल में रखते हैं।
(v) अधातुओं की क्षारों के साथ क्रिया थोड़ी जटिल होती हैं।
कार्बन (Carbon)
कार्बन भू-पर्पटी में पाया जाने वाला सत्रहवाँ अतिबाहुल्य तत्व है इसका परमाणु क्रमांक 6 तथा द्रव्यमान संख्या 12 है। यह आवर्त सारणी के 14 या IV A समूह, आवर्त 2 तथा p-ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास 1s2,2s2 2p2 है।

कार्बन के अपररूप (Allotropes of Carbon)
कार्बन विभिन्न अपररूप दर्शाता है क्रिस्टलीय और अक्रिस्टलीय दोनों प्रकार के। डायमण्ड, ग्रेफाइट और फुलरीन्स कार्बन के क्रिस्टलीय रूप हैं, जबकि कार्बन ब्लैक, कोक, काष्ठ चारकोल, कोल, आदि इसके अक्रिस्टलीय रूप हैं। किसी तत्व अथवा यौगिक का दो या दो से अधिक अपररूपों जिनके रासायनिक गुण समान लेकिन भौतिक गुण भिन्न हो, में विद्यमान होना अपररूपता (allotropy) कहलाता है। ये विभिन्न रूप अपररूप (allotropes) या अपररूपीय संशोधन (allotropic modifications) कहलाते हैं।
हीरा (Diamond)
यह बेशकीमती रत्नों की तरह प्रयुक्त होने वाला पत्थर है। यह प्रकृति में किम्बरलाइट पत्थर (kimberlite stone) के रूप में पाया जाता है। इसकी शुद्धता को कैरेट में मापा जाता है (1 कैरेट = 200 mg ) । हीरे के विभिन्न रूप कुलिनान (3032 कैरेट), होप (445 कैरेट), कोहिनूर (186 कैरेट) और पिट ( 136.2 कैरेट), आदि नाम से जाने जाते हैं। – हीरे में प्रत्येक कार्बन परमाणु अन्य चार कार्बन परमाणुओं से चतुष्फलकीय ढंग से जुड़कर दृढ़ त्रिविमीय जालक का निर्माण करते हैं। इस संरचना में सम्पूर्ण जालक में दिशात्मक सहसंयोजक आबन्ध उपस्थित रहते हैं। इस प्रकार विस्तृत सहसंयोजक आबन्धन को तोड़ना कठिन होता है। अत: हीरा पृथ्वी पर पाया जाने वाला सर्वाधिक कठोर पदार्थ है। )
गुण (Properties
(i) शुद्ध हीरा पारदर्शक एवं रंगहीन ठोस होता है।
(ii) इसका घनत्व और अपवर्तनांक क्रमश: 3.67 और 2.44 हैं।
(iii) यह अक्रिय और अत्याधिक विषैला है।
(iv) यह मुक्त इलेक्ट्रॉनों की अनुपस्थिति के कारण विद्युत का कुचालक है लेकिन ऊष्मा (ताप) का चालन कर सकता है।
(v) शुद्ध रूप में यह X-किरणों के लिए पारदर्शी होता है लेकिन अशुद्ध रूप में नहीं। अतः X-किरणें शुद्ध और संश्लेषित हीरों में भेद करने में प्रयुक्त की जा सकती हैं।
(vi) के साथ यह पोटैशियम डाइक्रोमेट (K2Cr2O7) और सान्द्र H2SO4 200°C पर गर्म करने पर CO2 गैस देता है। यह गैस तब भी निकलती है जब हीरे को वायु में लगभग 700-900°C पर गर्म किया जाता है।
उपयोग (Uses) रंगीन हीरे का उपयोग
(i) कठोर उपकरणों की धार तेज करने के लिए अपघर्षक के रूप में (रॉक ड्रिलिंग मशीन बनाने में, काँच कर्तन युक्तियों में, रत्न कटर्स में)।
(ii) रूपदा (dyes) बनाने में ।
(iii) विद्युत प्रकाश लैम्प में टंगस्टन तन्तु के निर्माण में किया जाता है।
ग्रेफाइट (Graphite)
ग्रेफाइट में प्रत्येक कार्बन परमाणु समान तल में निकटवर्ती तीन अन्य कार्बन परमाणुओं से जुड़कर पट्कोणीय वलय (hexagonal ring) के रूप में व्यवस्थित होते हैं। प्रत्येक कार्बन परमाणु का चौथा इलेक्ट्रॉन मुक्त होता है और पूरे क्रिस्टल जालक में गमन करता है तथा ग्रेफाइट को विद्युत का उत्तम चालक बनाता है। ग्रेफाइट में द्विविमीय चादर जैसी संरचना होती हैं जो षटकोणीय व्यवस्थित (hexagonal arrays) परतों को एक दूसरे के ऊपर रखने से बनता है।
गुण (Properties)
(i) ग्रेफाइट अपनी परतीय संरचना के कारण मुलायम, मृदु और चिकना है। यह इतना मुलायम है कि इसका प्रयोग लैड पेन्सिल के रूप में कागज पर निशान बनाने के लिए किया जाता है। अत: इसे काला सीसा (black lead) नाम से भी जाना जाता है।
(ii) यह अधिकांश रसायनों जैसे अम्ल (तनु HNO3), क्षार आदि के प्रति अक्रिय है लेकिन अकेले गर्म करने पर या K2Cr2O7 और सान्द्र H2SO4 के मिश्रण के साथ यह CO2 देता है।
(iii) बहुत उच्च ताप पर तथा उचित उत्प्रेरक की उपस्थिति में गर्म करने पर यह हीरे में परिवर्तित हो जाता है। ( यद्यपि किसी भी दशा में हीरे का ग्रेफाइट में परिवर्तन सम्भव नहीं है) ।
उपयोग (Uses)
(i) इसका उपयोग इलेक्ट्रोड तथा कार्बन आर्क बनाने में (क्योंकि मुक्त इलेक्ट्रॉनों की उपस्थिति के कारण यह विद्युत का उत्तम चालक है।)
(ii) उच्च ताप पर दौड़ती मशीनों को संक्षारण तथा क्षति से बचाने के लिए स्नेहक के रूप में किया जाता है। शुष्क
(iii) इसका उपयोग लैड पेन्सिल बनाने में किया जाता है।
(iv) इसका उपयोग धातुओं को गलाने में प्रयुक्त होने वाली उच्च तापसह क्रुसिबल को बनाने में किया जाता है।
(v) इसका उपयोग नाभिकीय रिऐक्टर में मन्दक के रूप में किया जाता है।
फुलरीन ( Fullerene )
फुलीन कार्बन का शुद्धतम रूप है। इनका निर्माण ग्रेफाइट को विद्युत आर्क में हीलियम, ऑर्गन, आदि अक्रिय गैसों की उपस्थिति में गर्म करके किया जाता है। फुलरीन की संरचना पिन्जरानुमा होती है। C60 अणु की आकृति सॉकर बॉल के समान होती है इसे बकमिन्सटर फुलरीन (buckminster fullerene) कहते हैं। इसे ऐसा इसलिए कहते हैं क्योंकि इसकी संरचना वास्तुकार बकमिन्सटर फुलर के द्वारा बनाए गुम्बद आकार की संरचना से मिलती है।
उपयोग (Uses)
(i) ये सूक्ष्म बॉल बेरिंग और हल्की बैटरी बनाने में प्रयुक्त होते हैं।
(ii) ये नए स्नेहक, प्लास्टिक और दवाएँ बनाने में प्रयुक्त होते हैं।
लैम्प ब्लैक या काजल (Lamp Black or Soot)
यह कार्बन का शुद्धतम रूप है इसमें 95% कार्बन होता है। इसे हाइड्रोकार्बनों को वायु की सीमित मात्रा में जलाकर प्राप्त किया जाता है। इसका प्रयोग काली स्याही में काले वर्णक के रूप में, जूते की पॉलिश तथा टायरों (ऑटोमोबाइल) में फिलर के रूप में किया जाता है। इसका प्रयोग आँखों के काजल के रूप में भी किया जाता है।
चारकोल (Charcoal)
अपनी रन्ध्रीय रचना ओर अधिक पृष्ठ क्षेत्रफल के कारण यह कार्बन का अशुद्ध रूप है। इसकी गैसों को अवशोषित करने की क्षमता बहुत अधिक होती है। यह निम्न प्रकार का हो सकता है
(i) काष्ठ चारकोल (Wood Charcoal) यह लकड़ी को वायु की अनुपस्थिति में उच्च ताप पर गर्म करने से प्राप्त होता है। सक्रिय चारकोल अत्यधिक सरन्ध्रीय होने के कारण विषैली गैसों को अधिशोषित करने के लिए गैस मास्क में प्रयुक्त किया जाता है। इसका प्रयोग वॉटर फिल्टर में तथा वातानुकूलन प्रणाली में गन्ध को नियन्त्रित करने में किया जाता है। यह एक अच्छा अपचायक है तथा कीटाणुनाशक गुणों को दर्शाता है इसका प्रयोग विस्फोटकों को बनाने में किया जाता है।
(ii) अस्थि चारकोल (Bone Charcoal) यह अस्थियों के भंजक आसवन द्वारा प्राप्त किया जाता है। कार्बनिक पदार्थों का विरंजन इस चारकोल के प्रयोग द्वारा किया जाता है।
(iii) शर्करा चारकोल और रक्त चारकोल (Sugar Charcoal and Blood Charcoal) ये क्रमश: शर्करा और रक्त के भंजक आसवन द्वारा प्राप्त किए जाते हैं।
कोल (Coal)
विश्व का लगभग 90% कोयला उत्तरी गोलार्द्ध में पाया जाता है। यह वनस्पतिक पदार्थों के कार्बनीकरण (carbonisation) की प्रक्रिया द्वारा प्राप्त किया जाता है तथा यह ऊर्जा का अनवीकरणीय स्रोत या समाप्य स्रोत माना जाता है। कार्बन की प्रतिशत मात्रा के आधार पर कोयले की चार किस्में हैं।
ये इस प्रकार हैं
(a) पीट ( 50-60% C) यह निम्न श्रेणी का कोयला है।
(b) लिग्नाइट या भूरा कोयला ( 60-70% C )
(c) बिटुमिनस (78-86% C) कोयले की यह सामान्य किस्म है यह मुलायम होता है तथा घेरलू कार्यों में प्रयुक्त किया जाता है।
(d) एन्थ्रासाइट (94-98% C) यह अच्छा तथा उच्च श्रेणी का कोयला है इसका प्रयोग ईंधन के रूप में, कोल गैस तथा संश्लेषित पेट्रोल के निर्माण में किया जाता है।
कार्बन के ऑक्साइड (Oxides of Carbon)
मुख्यतया कार्बन के दो ऑक्साइड हैं कार्बन मोनॉक्साइड और कार्बन डाइऑक्साइड ।
कार्बन मोनॉक्साइड (Carbon Monoxide), CO
बनाने की विधि (Method of Preparation )
(i) ऑक्सीजन अथवा वायु की सीमित मात्रा में कार्बन या कार्बन युक्त ईंधन के अपूर्ण दहन पर CO प्राप्त होती है।
(ii) यह मोटर वाहनों के धुएँ के रूप में उत्पन्न होती है। अत: इसे शहरों का मुख्य प्रदूषक कहा जाता है।
गुण (Properties)
(i) यह वाटर गैस (CO + H2) अथवा संश्लेषण गैस और प्रोड्यूसर गैस (CO + N2) में भी उपस्थित होती है। दोनों को औद्योगिक ईंधन के रूप में प्रयोग किया जाता है।
(ii) यह रंगहीन, गन्धहीन तथा जल में लगभग अविलेय गैस है।
(iii) यह नीली लौ के साथ जलती है। यह सूर्य के प्रकाश की उपस्थिति में क्लोरीन गैस से अभिक्रिया करके विषैली गैस फॉस्जीन (कार्बोनिल क्लोराइड, COCl2) बनाती है।
(iv) यह लगभग वायु के समान भारी है।
(v) CO की विषैली प्रकृति हीमोग्लोबिन के साथ एक संकुल बनाने की इसकी योग्यता के कारण होती है। जो ऑक्सीजन- हीमोग्लोबिन संकुल से 300 गुना अधिक स्थाई होता है। यह रक्त की ऑक्सीजन वहन करने की योग्यता को घटाता है। अन्तत: इसका परिणाम मृत्यु के रूप में होता है।
उपयोग (Uses)
(i) इसका उपयोग धातु निष्कर्षण में अपचायक के रूप में किया जाता है।
(ii) इसका उपयोग धातु कार्बोनिल बनाने में किया जाता है।
(iii) इसका उपयोग मॉन्ड प्रक्रिया द्वारा निकैल धातु के शोधन में किया जाता है।
(iv) इसका उपयोग मेथिल ऐल्कोहॉल, सोडियम फॉर्मेट तथा फॉस्जीन गैस बनाने में किया जाता है।
कार्बन डाइऑक्साइड (Carbon Dioxide), CO2
यह कार्बन तथा कार्बन युक्त ईंधन के पूर्ण दहन पर प्राप्त होती है। चूने का पत्थर (लाइम स्टोन) भी गर्म होकर CO2 देता है। यह रंगहीन, गन्धहीन अम्लीय गैस है। यह पौधों और जन्तुओं में श्वसन की प्रक्रिया में उत्पन्न होती है। यह किण्वन की प्रक्रिया में भी उत्पन्न होती है। वायुमण्डल में यह ~ 0.03% आयतन से उपस्थित रहती है जहाँ से यह प्रकाश संश्लेषण की प्रक्रिया द्वारा हटाई जाती है। CO2 विषैली नहीं हैं लेकिन यह हरित गृह गैस है। वायु में इसकी बढ़ी हुई सान्द्रता भूमण्डलीय ताप वृद्धि (global warming) के लिए उत्तरदायी है। CO2 का जलीय विलयन कार्बोनिक अम्ल (H2CO3) कहलाता है। चूने के पानी में प्रवाहित करने पर यह चूने के पानी को दूधिया कर देती है। दूधियापन का कारण सफेद रंग के कैल्सियम कार्बोनेट का बनना है। यद्यपि CO2 अधिकता में प्रवाहित करने पर विलेयशील कैल्सियम बाइकार्बोनेट के बनने से दूधियापन लुप्त हो जाता है।
उपयोग (Uses)
(i) ठोस CO2 ( शुष्क बर्फ या ड्राई कोल्ड) का उपयोग आइसक्रीम, आदि के रूप में किया जाता है।
(ii) गैस CO2 का प्रयोग अधिक दाब पर कार्बोनीकृत मृदु पेय जैसे सोड़ा जल, कोल्ड ड्रिंक्स, आदि में किया जाता है।
(iii) इसका प्रयोग अग्निशामक के रूप में किया जाता है। अग्नि को बुझाने के लिए यह सोडियम बाइकार्बोनेट की तनु अम्ल से अभिक्रिया द्वारा उसी समय उत्पन्न की जाती है।
(iv) इसका प्रयोग यूरिया, कठोर स्टील, आदि के निर्माण में किया है।
कार्बोनिक अम्ल (Carbonic Acid) H2CO3
जब CO2 जल में घुलती है तो कार्बोनिक अम्ल बनता है। तथा यह द्विक्षारकी अम्ल है। H2CO2 / HCO3– बफर सिस्टम रक्त के pH को 7.42 से 7.26 के मध्य रखने में सहायता करता है।
सिलिकॉन (Silicon), Si
इसका परमाणु क्रमांक 14 तथा द्रव्यमान संख्या 28 है। यह आवर्त सारणी के समूह 14 या IV A, आवर्त 3 तथा p-ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास 1s2 , 2s2 2p6, 3s2 3p2 होता है।
यह प्रकृत्ति में सिलिका तथा सिलिकेट के रूप में पाया जाता है। यह भू-पर्पटी में बाहुल्यता से पाया जाने वाला ऑक्सीजन के बाद दूसरा तत्व है ( 26% भार से ) । यह अधातु तत्व है जो अपररूपता दर्शाता है।
उपयोग (Uses)
(i) यह सिरेमिक, काँच और सीमेन्ट का महत्त्वपूर्ण अवयव है।
(ii) अति उच्च शुद्ध Si का प्रयोग अर्द्धचालकों के रूप में, टॉजिस्टरों में तथा कम्प्यूटर चिप्स के निर्माण में किया जाता है।
(iii) यह पॉलिमर सिलिकॉन्स (silicones), शुष्कन कर्मक सिलिका जैल, सिलिका वाटिका और अम्ल प्रतिरोधी स्टील बनाने में प्रयुक्त किया जाता है।
(iv) इसका उपयोग कार्बोरण्डम तथा मिश्रधातुओं के निर्माण में किया जाता है।
सिलिकॉन के यौगिक (Compounds of Silicon )
(i) सिलिकॉन कार्बाइड (Silicon Carbide), SiC कृत्रिम हीरा है इसे कार्बोरण्डम भी कहा जाता है।
(ii) सिलिका (Silica), SiO2 इसका उपयोग काँच और सीमेन्ट के निर्माण में किया जाता है।
(iii) सिलिकॉन्स (Silicones) ये बहुलक है इनका उपयोग सीलित ग्रीस (sealent grease), विद्युतरोधी (electric insulator) तथा जल सहवस्त्र (waterproof fabrics) और शल्य क्रिया प्रसाधन-संयंत्र (surgical and cosmetic plants) बनाने में होता है।
(iv) सिलेन्स (Silanes) सिलिकॉन के हाइड्राइड हैं।
(v) क्रिस्टलीय क्वार्ट्ज (Crystalline quartz) इसका प्रयोग घड़ियाँ तथा दाब – विद्युत पदार्थ बनाने में किया जाता है।
नाइट्रोजन (Nitrogen),N2
इसकी खोज डी. रदरफोर्ड (1772) ने की थी। इसका परमाणु क्रमांक 7 तथा द्रव्यमान संख्या 14 है। यह आवर्त सारणी के समूह 15 या V A, आवर्त 2 तथा p-ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास 1s2, 2s22p3 होता है।
प्राप्ति (Occurrence)
वायुमण्डल में आण्विक नाइट्रोजन का आयतन 78% है भू-पर्पटी के खनिजों में यह सोडियम नाइट्रेट (चिली साल्टपीटर या चीली शोरा) तथा पोटैशियम नाइट्रेट (इण्डियन साल्टपीटर) के रूप में पाया जाता है। जन्तुओं तथा पेड़-पौधों में यह प्रोटीन के रूप में पाया जाता हैं तथा पौधे मृदा से नाइट्रोजन नाइट्रेट के रूप में प्राप्त करते हैं। यह यूरिया का मुख्य अवयव है ( 46% N ) । यह निम्न समस्थानिकों के रूप में पाया जाता है।
बनाने की विधियाँ (Methods of Preparation)
(i) इसका व्यवसायिक उत्पादन वायु के द्रवीकरण तथा प्रभाजी आसवन से किया जाता है।
(ii) प्रयोगशाला में इसे अमोनियम क्लोराइड के जलीय विलयन की सोडियम नाइट्राइट के साथ अभिक्रिया से बनाया जाता है।
गुण (Properties)
(i) यह एक रंगहीन, गन्धहीन, स्वादहीन, द्विपरमाणुक, अध्रुवीय तथा अविषैली गैस है।
(ii) यह कमरे के ताप पर अक्रिय है। उच्च ताप पर यह ऑक्सीजन और हाइड्रोजन से क्रिया करके क्रमश: ऑक्साइड और हाइड्राइड बनाती है।
(iii) यह धातुओं (जैसे Mg, Li, आदि) से भी क्रिया करके इनके संगत नाइट्राइड (Mg3 N2, Li3N) बनाती है।
उपयोग (Uses)
(i) इसका उपयोग अमोनिया तथा अन्य नाइट्रोजन युक्त औद्योगिक रसायनों के निर्माण में (जैसे कैल्सियम सायनामाइड) किया जाता है।
(ii) इसका उपयोग आयरन और स्टील उद्योगों मे अक्रिय वातावरण निर्मित करने में किया जाता है।
(iii) द्रव नाइट्रोजन का उपयोग जैविक पदार्थों, खाद्य सामग्री तथा बैलों के वीर्य के परिरक्षण में और क्रायो सर्जरी में किया जाता है।
(iv) इसका उपयोग विद्युत बल्बों और उच्च ताप मापने वाले तापमापी में किया जाता है।
नाइट्रोजन स्थिरीकरण (Nitrogen Fixation)
वायुमण्डलीय नाइट्रोजन का उपयोग किए जाने वाले रूपों जैसे नाइट्रेटों और नाइट्राइटों में परिवर्तन नाइट्रोजन स्थिरीकरण कहलाता है। यह प्राकृतिक (बिजली चमकने के समय तथा नाइट्रोजन स्थिर करने वाले बैक्टीरिया जैसे राइजोबियम द्वारा ) तथा कृत्रिम ( उर्वरकों) दोनों के द्वारा किया जाता है।
विनाइट्रीकरण (Denitrification)
विनाइट्रीकृत बैक्टीरिया द्वारा नाइट्रोजनी यौगिकों का गैस नाइट्रोजन में परिवर्तन विनाइट्रीकरण कहलाता है।
अमोनिया (Ammonia), NH3
सर्वप्रथम इसे जे. प्रीस्टले ने अमोनियम क्लोराइड तथा लाइम के मिश्रण को गर्म करके प्राप्त किया था और इसका नाम क्षारीय वायु रखा था। बाद में बर्थोलेट (Berthollet) ने सन् 1785 में इसकी पहचान की थी ( अमोनिया नाइट्रोजन और हाइड्रोजन का यौगिक है) ।
बनाने की विधि (Method of Preparation)
औद्योगिक पैमाने पर इसका निर्माण हैबर विधि से नाइट्रोजन और हाइड्रोजन से किया जाता है जिसमें Fe उत्प्रेरक का कार्य करता है और Mo वर्धक का कार्य करते हैं। यद्यपि इन दिनों Fe2O3 उत्प्रेरक तथा K2O और Al2O3 वर्धक का कार्य करते हैं।
◆ अमोनिया का जल में सान्द्र विलयन लिकर अमोनिया (liquor ammonia) कहलाता है।
◆ अमोनियम कार्बोनेट, (NH4 )2CO3 को स्मैल्टिंग साल्ट (smelting salt) तथा अमोनियम क्लोराइड की सान्द्र क्लोरोस्टैनिक अम्ल के साथ क्रिया के फलस्वरूप प्राप्त संकर को पिंक साल्ट (pink salt) कहते हैं ।
यह चतुष्फलकीय अणु (tetrahedral molecule) है जो एकाकी युग्म इलेक्ट्रॉनों की उपस्थिति के कारण त्रिकोणीय पिरामिडी संरचना ग्रहण कर लेता है। यह एक तीखी गन्ध वाली, रंगहीन, जल में अत्यन्त विलेय गैस है। इसे सूँघने पर छींके तथा आँसू आ जाते हैं।
इसका उपयोग अनेक नाइट्रोजनी उर्वरकों और नाइट्रिक अम्ल को बनाने में किया जाता है। द्रव अमोनिया का उपयोग प्रशीतक (refrigerant ) के रूप में किया जाता है।
नाइट्रोजन के ऑक्साइड (Oxides of Nitrogen)
नाइट्रोजन ऑक्सीजन से क्रिया करके अनेक ऑक्साइड जैसे डाइनाइट्रोजन ऑक्साइड (N2O), नाइट्रोजन मोनॉक्साइड (NO), डाइनाइट्रोजन ट्राइऑक्साइड (N2O3), नाइट्रोजन डाइऑक्साइड (NO2), डाइनाइट्रोजन टेट्राऑक्साइड (N2O4) तथा डाइनाइट्रोजन पेन्टाऑक्साइड (N2O5) बनाती है।
N2O और NO उदासीन ऑक्साइड हैं जबकि शेष अम्लीय ऑक्साइड हैं। नाइट्रस ऑक्साइड (N2O) को हँसाने वाली गैस (laughing gas) भी कहते हैं क्योंकि इसे सूँघने पर हँसी आती है। शल्य क्रिया और दाँतों की सर्जरी में इसका उपयोग निश्चेतक के रूप में किया जाता है । यद्यपि अधिक सूंघने पर मृत्यु हो सकती है।
नाइट्रोजन के ऑक्सीअम्ल (Oxyacids of Nitrogen)
नाइट्रोजन अनेक ऑक्सीअम्ल जैसे हाइपोनाइट्रस अम्ल, नाइट्रस अम्ल और नाइट्रिक अम्ल बनाता है। इन सभी में नाइट्रिक अम्ल अधिक महत्त्वपूर्ण है।
नाइट्रिक अम्ल (Nitric Acid), HNO3
बड़े पैमाने पर इसे ओस्टवॉल्ड प्रक्रम द्वारा अमोनिया के वायुमण्डलीय ऑक्सीजन द्वारा उत्प्रेरकीय ऑक्सीकरण से बनाया जाता है। यह बर्कलैण्ड आइड प्रक्रम (Birkland-Eyde process) और रिटॉर्ट (retorts) प्रक्रम द्वारा भी बनाया जाता है।
यह एक रंगहीन द्रव है इसका जलीय विलयन प्रबल अम्लीय है। यह एक प्रबल ऑक्सीकारक है तथा सोना व प्लेटिनम जैसी उत्कृष्ट धातुओं को छोड़कर अधिकतर धातुओं के साथ अभिक्रिया करता है। ऐलुमिनियम तथा क्रोमियम इसमें नहीं घुलते हैं ऐसा इनकी सतह पर ऑक्साइड की रक्षक परत बनने के कारण होता है। इसे एक्वाफोर्टिस (strong water) भी कहते हैं क्योंकि यह लगभग सभी धातुओं पर आक्रमण (क्रिया) करता है।
उपयोग (Uses)
इसका उपयोग उर्वरकों के लिए अमोनियम नाइट्रेट बनाने में तथा विस्फोटकों जैसे नाइट्रोग्लिसरीन (डायनामाइट), ट्राइनाइट्रो टॉलुईन (TNT), ट्राइनाइट्रो फिनॉल (TNP) एवं पायरों तकनीक में प्रयुक्त होने वाले अन्य नाइट्रेटों के उत्पादन में किया जाता है।
नाइट्रस अम्ल (Nitrous Acid), HNO2
यह अस्थायी अम्ल है तथा यह ऑक्सीकारक तथा अपचायक दोनों का कार्य करता है। इसके लवणों को नाइट्राइट कहते हैं। नाइट्रस अम्ल (HNO2) के विलयन में रखा कार्बन डाइसल्फाइड और नाइट्रिक ऑक्साइड का मिश्रण फ्लैश फोटोग्राफी में प्रयुक्त किया जाता है।
अमोनियम क्लोराइड और सॉल अमोनिया (Ammonium Chloride or Sal Ammonia), NH4Cl
यह नौसादर नाम से भी जाना जाता है। यह सफेद रंग का क्रिस्टलीय पाउडर है। इसका उपयोग शुष्क बैटरियों में, धातुओं को जोड़ने से पहले उनकी सतह साफ करने तथा धातुओं पर कलई करने में और प्रयोगशाला अभिकर्मक के रूप में किया जाता है। इसका उपयोग औषध निर्माण और विद्युत लेपन में भी किया जाता है।
फॉस्फोरस (Phosphorus), P
यह एक क्रियाशील धातु है इसका परमाणु क्रमांक 15 तथा द्रव्यमान संख्या 31 है। यह आवर्त सारणी के समूह 15 या VA, आवर्त 3 तथा p-ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास 1s2, 2s2 2p6, 3s2 3p3 होता है।
प्राप्ति (Occurrence)
प्रकृति में यह अपने स्थाई फॉस्फेटों के रूप में पाया जाता है। यह प्राणियों एवं पादप पदार्थों का आवश्यक अवयव है। यह अस्थियों (इनमें 58% कैल्सियम फॉस्फेट होता है) तथा अन्य जीवित कोशिकाओं में उपस्थित होता है। यह अल्प मात्रा में प्राणियों के मूत्र तथा रक्त में भी पाया जाता है। फॉस्फोप्रोटीन्स दूध और अण्डों में उपस्थित होते हैं।
एक व्यस्क मानव में औसत (सामान्य) 0.7 किलोग्राम फॉस्फोरस होता है। इसके कुछ मुख्य खनिज हैं- फॉस्फोराइट [Ca3 (PO4)2], क्लोरेपेटाइट [Ca3 (PO4)2] तथा रेडोन्डा फॉस्फेट [AlPO4]। इसका निष्कर्षण मुख्यता फॉस्फोराइट अयस्क से विद्युत तापीय प्रक्रम द्वारा किया जाता है। यद्यपि लघु मात्रा में इसका निष्कर्षण हड्डियों की राख (bone ash) से पुरानी विधि (रिटॉर्ट विधि) से भी किया जाता है। यह निम्न समस्थानिक रूपों में पाया जाता है
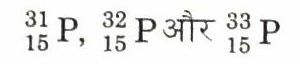
उपयोग (Uses)
(i) फॉस्फोरस DNA तथा RNA के संश्लेषण में महत्त्वपूर्ण भूमिका निभाता है।
(ii) यह फॉस्फर ब्राँज (phospher bronze) मिश्रधातु के रूप में विशिष्ट प्रकार के कण्टेनर (box) बनाने में प्रयुक्त होता है।
(iii) प्रकाश संश्लेषण की प्रक्रिया तथा पत्तियों के रंग के लिए यह आवश्यक है। इसकी कमी से पौधों में प्रकाश संश्लेषण नहीं होता है। जिससे पत्तियाँ अपना रंग खो देती है और सूख जाती है।
(iv) ऐलुमिनियम फॉस्फाइड के रूप में इसका प्रयोग अनाजों के परिरक्षण में किया जाता है।
फॉस्फोरस के अपररूप (Allotropic Forms of Phosphorus)
श्वेत/पीला फॉस्फोरस (White/Yellow Phosphorus)
यह चतुष्फलकीय P4 अणुओं से बना होता है जिसमें प्रत्येक P परमाणु दूसरे तीन परमाणुओं से एकल बन्ध द्वारा बन्धे होते हैं। श्वेत फॉस्फोरस बहुत अधिक क्रियाशील है यह कक्ष ताप पर आग पकड़ लेता है क्योंकि इसका ज्वलन ताप 30°C है। यही कारण है कि इसे जल में रखा जाता है। इसका जलना स्वत: ज्वलन (self ignition) कहलाता है। यह CS2 में घुल जाता है तथा जल में अविलेय है। यह पारभासी श्वेत मोमी ठोस है। यह विषैला और लहसुन जैसी गन्ध वाला है। यह प्रकाश में रखने पर पीला पड़ जाता है। यही कारण है कि इसको पीला फॉस्फोरस नाम दिया गया है।
यह अँधेरे में दीप्त होता है (रसोसंदीप्ति)। अक्रिय वायुमण्डल में यह उबलते हुए सोडियम हाइड्रॉक्साइड विलयन में घुलकर फॉस्फीन (PH3) देता है। इसका आकार एकाकी इलेक्ट्रॉन युग्म होने के कारण पिरैमिडीय होता है।
उपयोग (Uses)
इसका उपयोग अतिशबाजी (पटाखें), अग्नि बम और धूम्र बमों में किया जाता है।
◆ फॉस्फोरस के साथ कार्य करने वाले लोगों में फॉसी जबड़ा (Phossy jaw) नामक बिमारी हो जाती है जिसमें जबड़े की हड्डियों का क्षय हो जाता है।
स्फुरदीप्ति अथवा रसोसंदीप्ति (Phosphorescence or Chemiluminescence)
श्वेत फॉस्फोरस वायु में अपने मंद दहन के कारण अँधेरे में चमकता है और पीला हरा प्रकाश उत्पन्न करता है। यह गुण स्फुरदीप्ति अथवा रसोसंदीप्ति कहलाता है। ऑक्सीकरण की ऊर्जा ऊष्मा के रूप में मुक्त नहीं होती है लेकिन यह प्रकाश के रूप में उत्सर्जित होती है।
लाल फॉस्फोरस (Red Phosphorus)
लाल फॉस्फोरस P4 अणु तथा रेखीय आकृति वाला संरचना में बहुलकी है। यह लाल क्रिस्टलीय ठोस है। यह श्वेत फॉस्फोरस को अक्रिय वातावरण में 573 K ताप पर गर्म कर प्राप्त होता है। यद्यपि लाल फॉस्फोरस को 523 K ताप पर N2, CO2, आदि गैसों की उपस्थिति में गर्म करने पर इसकी वाष्प प्राप्त होती है। ये वाष्प संघनित होकर पुन: श्वेत फॉस्फोरस देती है।
यह गन्धहीन, प्रकृति में अविषैला और जल तथा CS2 में अविलेय है। रासायनिक रूप से लाल फॉस्फोरस, श्वेत फॉस्फोरस की तुलना में बहुत कम क्रियाशील होता है। यह आग नहीं पकड़ता है क्योंकि इसका ज्वलन ताप उच्च (260°C) होता है। यह अँधेरे में दीप्त नहीं होता है।
उपयोग (Uses)
दूसरे रसायनों के साथ इसका उपयोग माचिस (रगड़ने वाली सतह) में किया जाता है।
काला फॉस्फोरस (Black Phosphorus)
यह सफेद फॉस्फोरस को 200°C तथा उच्च दाब पर गर्म करने पर प्राप्त होता है। इसके दो रूप होते हैं, α-काला फॉस्फोरस तथा β-काला फॉस्फोरस । α-काला फॉस्फोरस वायु में उर्ध्वपातित किया जा सकता है। यह वायु में ऑक्सीकृत नहीं होता है।
β-काला फॉस्फोरस वायु में 673 K ताप तक नहीं जलता है। यह विद्युत का सुचालक है। इसका रंग काला है तथा यह CS2 में मिश्रणीय (विलेय) है। यह लाल फॉस्फोरस की तरह अक्रिय है।
सिन्दूरी फॉस्फोरस (Scarlet Phosphorus)
यह सफेद फॉस्फोरस के 10% विलयन को PBg में लगभग 10 घण्टे तक गर्म करने पर प्राप्त किया जाता है। यह लाल क्रिस्टलीय ठोस है जो कार्बन डाइसल्फाइड (CS2) में मिश्रणीय है। यह अविषैला पदार्थ है। यह लाल फॉस्फोरस की अपेक्षा अधिक क्रियाशील है। लेकिन यह सामान्य ताप पर वायु में आग नहीं पकड़ता है।
बैंगनी फॉस्फोरस (Violet Phosphorus)
इसे हिटॉर्फ फॉस्फोरस भी कहते हैं, क्योंकि इसकी खोज हिटॉर्फ ने की थी। यह सफेद फॉस्फोरस को बन्द नली में 803K ताप पर गर्म करके प्राप्त किया जाता है। नाम के अनुसार इसका रंग बैंगनी है। यह अज्वलनशील तथा विद्युत का कुचालक है।
उपयोग (Uses)
(i) यह होम्ज सिग्नलों में [ Holme’s signals (marine ships indicator) समुद्री जहाजों को संकेत देने वाले] कैल्सियम फॉस्फाइड के रूप में प्रयुक्त की जाती है जो जल से अभिक्रिया करके अशुद्ध फॉस्फीन देता है। प्राप्त फॉस्फीन आग पकड़ती है तथा मेटाफॉस्फोरिक अम्ल का सघन धुआँ बनता है।
(ii) यह युद्ध में धूम्रपट ( smoke screens) में प्रयुक्त की जाती है।
फॉस्फोरस के ऑक्साइड (Oxides of Phosphorus)
फॉस्फोरस ट्राइऑक्साइड और फॉस्फोरस पेन्टाऑक्साइड।
फॉस्फोरस ट्राइऑक्साइड (Phosphorus Trioxide), P2O3
(i) यह द्विलक, P4O6 के रूप में मिलता है।
(ii) यह श्वेत फॉस्फोरस के वायु में सीमित मात्रा में जलने से बनता है।
फॉस्फोरस पेन्टाऑक्साइड (Phosphorus Pentaoxide), P2O5
यह फॉस्फोरिक अम्ल का ऐनहाइड्राइड है। गर्म करने पर उर्ध्वपातित हो जाता है यह मोमी श्वेत अम्लीय पाउडर है। जो जल से तीव्रता से क्रिया कर ऑर्थोफास्फोरिक अम्ल देता है। इसकी संरचना नियमित चतुष्फलकीय है।
उपयोग (Uses)
इसका उपयोग निर्जलीकारक के रूप में किया जाता है। यह सल्फ्यूरिक अम्ल को सल्फर ट्राइऑक्साइड में, नाइट्रिक अम्ल को डाइनाट्रोजन पेन्टाऑक्साइड में तथा सैलुलोस को कार्बन में परिवर्तित कर देता है।
फॉस्फोरस के ऑक्सीअम्ल (Oxyacids of Phosphorus)
फॉस्फोरस अनेक ऑक्सीअम्ल बनाता है।

◆ ऑर्थोफॉस्फोरिक अम्ल ऑर्थोफॉस्फोरस अम्ल तथा हाइपोफॉस्फोरस अम्ल की क्षारकता क्रमशः 3, 2, 1 है।
◆ हाइपोफॉस्फोरस यौगिकों का प्रयोग बलवर्धक दवाओं में किया जाता है।
◆ हड्डियों का मुख्य अवयव हाइड्रॉक्सी एपेटाइट कैल्सियम फॉस्फेट का अक्रिस्टलीय रूप है।
ऑक्सीजन (Oxygen), O2
इसकी खोज सर्वप्रथम स्वीडन के वैज्ञानिक शीले ( Scheele, 1772 ) ने की थी तथा इसे ऑक्सीजन नाम एएल लेवोइजर (AL Lavoisier) ने सन् 1977 में दिया। इसका परमाणु क्रमांक 8 तथा द्रव्यमान संख्या 16 है। यह आवर्त सारणी के समूह 16 या VI A, आर्वत 2 तथा p-ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास 1s2, 2s2 2p4 होता है। यह निम्न समस्थानिक रूपों में पाया जाता है
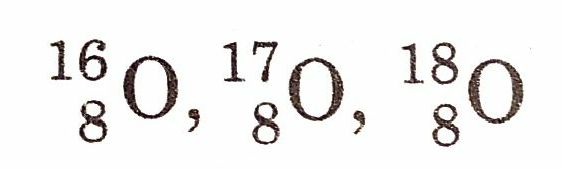
प्राप्ति (Occurrence)
पृथ्वी पर सभी तत्वों में से ऑक्सीजन सबसे अधिक प्रचुरता में पाई जाती है। भू-पर्पटी के द्रव्यमान का लगभग 46.6% ऑक्सीजन से निर्मित है। शुष्क वायु में यह आयतन के अनुसार 20.946% है। वायुमण्डलीय ऑक्सीजन का मुख्य स्रोत प्रकाश संश्लेषण है। प्रयोगशाला में इसे पोटैशियम क्लोरेट (KClO3) को मैग्नींज डाइऑक्साइड उत्प्रेरक की उपस्थिति में 375°C ताप पर गर्म करके प्राप्त किया जाता है। औद्योगिक रूप से इसे वायु से प्रभाजी आसवन द्वारा प्राप्त किया जाता है।
गुण (Properties)
(i) डाइऑक्सीजन रंगहीन, गन्धहीन गैस है, जो ठण्डा करने पर गहरे नीले रंग के द्रव में परिवर्तित हो जाती है।
(ii) यह वायु से हल्की सी भारी है।
(iii) यह स्वयं नहीं जलती है लेकिन दहन में सहायक होती है।
(vi) जल में इसकी विलेयता समुद्री तथा जलीय जीवन के लिए पर्याप्त है।
(v) यह अनुचुम्बकीय प्रकृति की होती है।
(vi) यह लगभग सभी धातुओं को (Au, Pt) छोड़कर तथा अधातुओं तथा कुछ उत्कृष्ट गैसों से अभिक्रिया करती है।
उपयोग (Uses)
यह श्वसन गैस है तथा ईंधनों के दहन में सहायक है। इसका उपयोग ऑक्सी ऐसीटिलिन वैल्डिंग में, अनेक धातुओं जैसे स्टील के उत्पादन में किया जाता है अस्पतालों, अत्यधिक ऊँचाई पर उड़ानों तथा पर्वतरोहण में ऑक्सीजन के सिलेण्डर (जिनमें ऑक्सजीन को हीलियम से तनुकृत किया जाता है) का उपयोग रॉकेट ईंधन में ऑक्सीकारक के रूप में किया जाता है।
◆ यदि पृथ्वी पर उपस्थित सभी वनस्पतियों को नष्ट कर दिया जाए तो ऑक्सीजन की अनुपस्थिति के कारण पृथ्वी पर जीवन लुप्त हो जायेगा।
ओजोन (Ozone), O3
यह ऑक्सीजन का अपररूप (allotropic) है रासायनिक तौर पर यह त्रिपरमाणुक गैस है। यह लगभग 20 किमी ऊँचाई पर सूर्य के प्रकाश की उपस्थिति में वायुमण्डलीय ऑक्सीजन से बनती है। ओजोन परत भू-पृष्ठ को पराबैंगनी विकिरणों से बचाती है। नाइट्रिक ऑक्साइड (NO) जो सुपरसोनिक जेट वायुयानों के निकास तन्त्र से उत्सर्जित होती है तथा क्लोरोफ्लोरो कार्बन ओजोन परत को नष्ट करते हैं।
गुण (Properties)
यह ऑक्सीकारक और अपचायक दोनों की तरह कार्य करती है। यह असंतृप्त यौगिकों जैस एथीन और एथाइन से क्रिया करके मोनोओजोनाइड बनाती है। सिल्वर को अनावृत करने पर यह सिल्वर को अत्यधिक चमकीला काला कर देती है।
इसका उपयोग कीटाणु विसंक्रामी (जर्मनाशी) तथा जल को रोगाणुरहित करने में किया जाता है। इसका उपयोग तेलों, हाथी दाँत, आटे, स्टार्च, आदि के विरंजित करने में तथा कृत्रिम सिल्क बनाने में किया जाता है।
सल्फर (Sulphur), S
संस्कृत के शुल्वारि (ताँबे का शत्रु) शब्द से सल्फर शब्द की उत्पत्ति हुई। सल्फर का परमाणु क्रमांक 16 तथा द्रव्यमान संख्या 32.06 है। यह आवर्त सारणी के समूह 16 या (VI), आवर्त 3 तथा p-ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास 1s2, 2s2 2p6, 3s2 3p4 होता है।
प्राप्ति एवं निष्कर्षण (Occurrence and Extraction)
इसकी भू-पर्पटी में उपलब्धता केवल 0.03% से 0.1% है। अण्डे, प्रोटीन, लहसुन, प्याज, सरसों, बाल, तथा ऊन इन सभी में सल्फर होती है। तत्व रूप में सल्फर गर्म झरनों के पास ज्वालामुखी क्षेत्रों जैसे इटली के सिसली द्वीप तथा जापान, आदि में पाई जाती है। प्रकृति में सल्फर संयुक्त अवस्था में सल्फाइडों जैसे FeS, HgS, PbS, ZnS, आदि तथा सल्फेटों जैसे CaSO4 · 2H2O (जिप्सम), आदि के रूप में पाई जाती है। व्यापारिक रूप से इसे फ्रॉश विधि (Frasch’s process ) तथा सिसिलिअन विधि (Sicilian’s process) द्वारा प्राप्त किया जाता है।
सल्फर के अपररूप (Allotropic Forms of Sulphur)
सल्फर के अनेक अपररूप है जिसमें पीली विषमलम्बाक्ष (α- सल्फर) तथा एकनताक्ष (β-सल्फर) रूप अति महत्त्वपूर्ण है।
क्रिस्टलीय अपररूप (Crystalline Allotropic Forms)
(i) विषमलम्बाक्ष सल्फर या अष्टफलकीय सल्फर या α सल्फर (Rhombic Sulphur or Octahedral Sulphur or a-Sulphur)
यह कक्ष ताप पर सल्फर का सर्वाधिक स्थाई रूप है। यह पीले रंग का तथा भंगुर है। इसके वलय में सल्फर के 8 परमाणु होते हैं जो प्रकुचित वलय संरचना बनाते हैं।
इसके क्रिस्टल गन्धक शलाका के CS2 में विलयन को वाष्पीकृत करके बनाए जाते हैं। यह जल में अविलेय है लेकिन CS2 में पूर्णतया विलेय है। यह विद्युत का कुचालक है। लोहे के चूर्ण के साथ क्रिया करने पर यह फेरस सल्फाइड (FeS) बनाती है।
(ii) एकनताक्ष सल्फर या B-सल्फर (Monoclinic Sulphur or B-Sulphur)
यह 369 K के ऊपर ताप पर स्थाई है तथा इसके नीचे ताप पर α-सल्फर में रूपान्तरित हो जाती है। 369 K ताप पर दोनों रूप स्थाई है। अत: यह ताप संक्रमण ताप (transition temperature) कहलाता है।
अक्रिस्टलीय अपररूप (Non-Crystalline Allotropic Forms)
(i) प्लास्टिक सल्फर
(ii) श्वेत सल्फर
(iii) दूधिया सल्फर
उपयोग (Uses)
(i) इसका उपयोग रसायनों जैसे SO2, H2SO4, CS2 के निर्माण में किया जाता है।
(ii) इसका उपयोग औषधियों, मलहमों तथा विरंजक के रूप में किया जाता है।
(iii) इसका उपयोग रंग तथा रंजक उद्योगों में, जीवाणुनाशी, कीटाणुनाशी तथा कवकनाशी के रूप में किया जाता है।
(iv) सल्फर का उपयोग रबड़ को वल्कनीकृत करने में किया जाता है।
(v) विटामिनों जैसे बायोटिन और थाइमीन में सल्फर अपने कार्बनिक रूप में पाई जाती है।
(vi) दूधिया सल्फर औषधियों में प्रयुक्त की जाती है।
(vii) गन पाउडर, सल्फर, चारकोल और पोटैशियम नाइट्रेट का मिश्रण है।
◆ यदि सल्फर को उबालकर ठण्डे जल में रखकर ठण्डा किया जाए तो यह प्लास्टिक सल्फर में परिवर्तित हो जाती है।
◆ सल्फर की तीखी गन्ध का कारण सल्फ्यूरस यौगिकों की उपस्थिति है।
सल्फर के ऑक्साइड (Oxides of Sulphur)
ये सल्फर डाइऑक्साइड और सल्फर ट्राइऑक्साइड है।
सल्फर डाइऑक्साइड (Sulphur Dioxide), SO2
यह ज्वालामुखी से निकलने वाली गैसों में मुख्य है। यह तीखी गन्ध वाली रंगहीन गैस है। यह जल में अत्यधिक विलेय है। यह हवा से भारी, दम घोटने वाली विषैली गैस है। इसके अणु की संरचना कोणीय होती है। इसका जलीय विलयन सल्फ्यूरस अम्ल कहलाता है। यह सल्फ्यूरस अम्ल का ऐनहाइड्राइड है।
उपयोग (Uses)
(i) यह प्रशीतक (क्योंकि इसे द्रवित किया जा सकता है), प्रतिक्लोर विसंक्रामक परिरक्षक तथा ऊन और रेशम के लिए विरंजक के रूप में प्रयुक्त की जाती है यद्यपि इसकी विरंजन क्रिया अस्थाई है।
(ii) इसका उपयोग पेट्रोलियम तथा चीनी के शोधन में किया जाता है। सल्फ्यूरिक अम्ल तथा अन्य रसायन SO2 से बनाए जाते हैं। द्रव SO2 का उपयोग अनेक रसायनों के लिए विलायक के रूप में किया जाता है।
◆ CO2 की तरह SO2 चूने के पानी को कैल्सियम सल्फाइट के बनने के कारण दूधिया कर देती है। अधिकता में SO2 प्रवाहित करने पर कैल्सियम बाइसल्फाइट के बनने के कारण दूधियापन लुप्त हो जाता है।
सल्फर ट्राइऑक्साइड (Sulphur Trioxide), SO3
यह अम्लीय ऑक्साइड (सल्फ्यूरिक अम्ल का ऐनहाइड्राइड) है जो जल में उष्मा निर्गमन के साथ घुलकर सल्फ्यूरिक अम्ल बनाता है। इसका उपयोग सल्फ्यूरिक अम्ल तथा ओलियम बनाने में किया जाता है। यह अन्य गैसों के लिए निर्जलीकारक के रूप में प्रयुक्त किया जाता है।
सल्फर के ऑक्सीअम्ल (Oxyacids of Sulphur)
सल्फ्यूरस अम्ल H2SO3, सल्फ्यूरिक अम्ल H2SO4, परऑक्सोडाइसल्फ्यूरिक अम्ल H2S2O8 तथा पायरोसल्फ्यूरिक अम्ल (ओलियम) H2S2O7 सल्फर के ऑक्सीअम्ल हैं।
सल्फ्यूरस अम्ल (Sulphurous Acid), H2SO3
यह प्रबल द्विक्षारकी अम्ल है यह लवणों की दो श्रेणियाँ देता है। सामान्य सल्फाइट तथा अम्लीय सल्फाइट (बाइसल्फाइट)। यह ऑक्सीकारक और अवकारक दोनों की तरह कार्य करता है। इसका विरंजक गुण SO2 के समान (अवकारक गुण के कारण) होता है।
सल्फ्यूरिक अम्ल (Sulphuric Acid), H2SO4
इसे कसीस के तेल और रसायनों का सम्राट भी कहा जाता है। औद्योगिक पैमाने पर इसे दो विधियों द्वारा बनाया जाता है—सम्पर्क विधि और सीसा कक्ष विधि (contact process and lead chamber process)। दोनों विधियों में SO2 को SO3 में परिवर्तित किया जाता है। सम्पर्क विधि में इस अभिक्रिया का उत्प्रेरण प्लेटिनम (Pt), प्लेटिनीकृत एस्बेस्टॉस, वैनेडियम पेन्टॉक्साइड (V2O5), फैरिक ऑक्साइड, आदि के द्वारा किया जाता है, जबकि सीसा कक्ष विधि में नाइट्रोजन के ऑक्साइडों द्वारा इसका उत्प्रेरण किया जाता है।
सल्फ्यूरिक अम्ल रंगहीन, गाढ़ा तैलीय द्रव है। यह जल में अत्यधिक ऊष्मा निर्गमन के साथ घुलता है। सल्फ्यूरिक अम्ल भी लवणों की दो श्रेणियाँ देता है। सामान्य लवण (जैसे सोडियम सल्फेट) तथा अम्लीय सल्फेट (जैसे सोडियम हाइड्रोजन सल्फेट)। शुद्ध सल्फ्यूरिक अम्ल का विद्युत अपघटन करने पर ऐनोड पर मार्शल अम्ल (H2S2O8) प्राप्त होता है।
उपयोग (Uses)
(i) इसका उपयोग पेट्रोलियम के शोधन में, अपशिष्ट जल के उपचार में तथा खनिजों के निष्कर्षण में किया जाता है।
(ii) इसका उपयोग विस्फोटकों (पिक्रिक अम्ल, TNT (नाइट्रोग्लिसरीन), गन कॉटन), औषधियों, विसंक्रामियों, प्रलेपों (paints), वर्णकों, उर्वरकों तथा अपमार्जकों, आदि के निर्माण में किया जाता है।
(iii) इसका उपयोग ऑक्सीकारक तथा शुष्ककारक के रूप में किया जाता है।
(iv) इसका उपयोग महत्त्वपूर्ण रसायनों जैसे फिटकरी, ईथर, धातु, सल्फेटों, आदि के निर्माण में किया जाता है।
(v) संचायक बैटरियों में भी इसका उपयोग किया जाता है।
◆ यदि चीनी को सान्द्र H2SO4 के साथ अभिकृत कराया जाता है तो निर्जलीकरण के कारण यह काली पड़ जाती है।
पायरोसल्फ्यूरिक अम्ल या ओलियम (Pyrosulphuric Acid or Oleum), H2S2O7
इसे सधूम सल्फ्यूरिक अम्ल भी कहते हैं। जब SO3 को सान्द्र सल्फ्यूरिक अम्ल में अवशोषित कराया जाता है तो पायरोसल्फ्यूरिक अम्ल प्राप्त होता है। जो जल अपघटित होकर पुन: H2SO4 देता है।
हाइड्रोजन सल्फाइड (Hydrogen Sulphide), H2S
यह अल्प मात्रा में ज्वालामुखी से निकलने वाली गैसों में पाई जाती है। यह रंगहीन, विषैली तथा सडे अण्डे की गन्ध वाली गैस है। H2S की अधिक मात्रा घातक सिद्ध होती है। तनु क्लोरीन जल H2S का विषहर (antidote) है।
हैलोजन ( Halogens)
फ्लुओरीन, क्लोरीन, ब्रोमीन, आयोडीन तथा ऐस्टैटीन समूह 17 के सदस्य है इन्हें हैलोजन भी कहते हैं। (ग्रीक भाषा में हैलो का अर्थ है ‘लवण’ तथा जेनेस का अर्थ ‘उत्पन्न करना’ अर्थात् लवण पैदा करने वाला) हैलोजन अति क्रियाशील अधातु तत्व हैं। ऐस्टैटीन रेडियोधर्मी तत्व है।
इनका बाह्यतम कोश का इलेक्ट्रॉनिक विन्यास ns2 np5 होता है। बहुत अधिक क्रियाशील होने के कारण ये तत्व हमेशा संयुक्त अवस्था में पाए जाते हैं। ये सभी रंगीन तत्व है क्योंकि ये दृश्य प्रकाश अवशोषित करते हैं।
फ्लुओरीन (Fluorine),F
इसका परमाणु क्रमांक 9 तथा द्रव्यमान संख्या 19 है। इसका इलेक्ट्रॉनिक विन्यास 1s2 2s2 2p5 होता है। इसको मॉयसन (Moissan 1886) ने अलग किया था। यह पीले रंग की गैस है। हैलोजनों में यह सर्वाधिक क्रियाशील तत्व है। यह जल से क्रिया करता है तथा इसे O2 में ऑक्सीकृत कर देता है। यह ऑक्सीजन से क्रिया करके दो प्रकार के फ्लुओराइड O2F2 तथा OF2 बनाती है और यह नाइट्रोजन को छोड़कर अधातुओं से क्रिया करती है। फ्लुओरीन सर्वाधिक ऋण विद्युती तत्व है।
उपयोग (Uses)
(i) इसके यौगिक O2F2 और OF2 प्रबल फ्लुओरीनन कारक हैं। O2F2 प्लूटोनियम को PuF6 में ऑक्सीकृत कर देता है।
(ii) इस अभिक्रिया का उपयोग अवशेष नाभिकीय ईंधन (spent nuclear fuel) में से प्लूटोनियम को PuF6 के रूप में हटाने के लिए किया जाता है।
क्लोरीन (Chlorine), Cl
इसे ऑक्सीम्यूरेटिक अम्ल ( oxymuriatic acid) भी कहा जाता है। इसकी खोज शीले (1774) ने की थी। यह p-ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास 1s2, 2s2 2p6 3s2 3p5 होता है।
औद्योगिक स्तर पर क्लोरीन का निर्माण डीकन विधि, बेल्डन विधि, केल्मर सॉल्वे विधि या नेल्सन सेल में ब्राइन के विद्युत अपघटन द्वारा किया जाता है। यह तीखी गन्ध वाली दमघोटू; हरित पीली (greenish yellow) गैस है। यह वायु से 2.5 गुना भारी है यह जल में विलेय है। यह धातु और अधातुओं से क्रिया करके क्लोराइड बनाती है। इसका ऑक्सीकारक और विरंजन क्रिया नवजात ऑक्सीजन के उत्पन्न होने के कारण है। यह केवल नमी की उपस्थिति में विरंजन क्रिया दर्शाता है। अत: इसका विरंजक प्रभाव स्थाई है यह शुष्क बूझे चूने से क्रिया करके विरंजक चूर्ण (bleaching powder, CaOCl2) देती है।
उपयोग (Uses) इसके उपयोग निम्नलिखित हैं
(i) काष्ठ लुगदी (कागज तथा रेऑन के उत्पादन में आवश्यक होती है) कपास तथा वस्त्रों के विरंजन में।
(ii) सोने तथा प्लेटनिम के निष्कर्षण में।
(iii) रंजकों, औषधियों तथा कार्बनिक पदार्थों जैसे CCl4, CHCl3, DDT, प्रशीतकों, आदि के उत्पादन में।
(iv) पीने के जल को जीवाणुरहित करने में।
(v) विषैली गैसों जैसे फॉस्जीन (COCI2), आँसू गैस (CCI3 NO2), मस्टर्ड गैस (CICH2 CH2 SCH2 CH2 CI) के बनाने में किया जाता है।
ब्रोमीन (Bromine), Br
इसे सर्वप्रथम बेलार्ड (Balard) ने 1826 में बनाया था। इसका परमाणु क्रमांक 35 तथा द्रव्यमान संख्या 79.9 है। इसका इलेक्ट्रॉनिक विन्यास [Ar] 3d10, 4s2 4p5 होता है। यह लाल भूरा द्रव है। समुद्री जल में इसकी मात्रा लगभग 0.068% है। इसका निष्कर्षण मुख्यता कार्नेलाइट अयस्क से किया जाता है भारत में कच्छ के रन (Run of Kachchh) में ब्राइन के रूप में पाई जाती है। यह स्टार्च पेपर को पीला कर देती है। इसका ऑक्सीकारक तथा विरंजक का कार्य नवजात ऑक्सीजन के उत्पन्न होने के कारण है।
उपयोग (Uses)
इसका उपयोग ब्रोमाइड, हाइपोब्रोमाइट तथा ब्रोमाइट लवणों के निर्माण में किया जाता है। य फोटोग्राफी में सिल्वर ब्रोमाइड के रूप में तथा कार्बनिक रसायन में प्रतिकारक के रूप में प्रयुक्त किया जाता है। इसका उपयोग आँसू गैसों तथा विषैली गैसों को बनाने में भी किया जाता है। यह KBr के रूप में नींद लाने वाली दवा में तथा दर्द निवारक में प्रयुक्त किया जाता है।
आयोडीन (Iodine), I
सर्वप्रथम इसकी खोज कौर्टोइस (Courtois) ने सन् 1811 में समुद्री खरपतवार (sea weeds) की राख से की थी। इसका परमाणु क्रमांक 53 है है। इसका इलेक्ट्रॉनिक संख्या 126.9 विन्यास तथा द्रव्यमान [Kr] 4d10, 5s2 5p5 होता है। यह संयुक्त अवस्था में समुद्री जल और समुद्री खरपतवार में आयोडाइड के रूप में पाई जाती है। यह गहरे बैंगनी रंग का अधात्विक चमकदार क्रिस्टलीय ठोस है। (धात्विक चमक वाला) इसकी वाष्प बैंगनी रंग की होती है। मानव शरीर में यह थायरॉइड ग्रन्थि द्वारा स्त्रावित थायरॉक्सिन नामक कार्बनिक यौगिकों के रूप में पाया जाता है। मानव शरीर में इसकी कमी थायरॉइड के कार्य में बाधा पहुँचाती है तथा घेंघा या गलगण्ड नामक बिमारी हो जाती है।
उपयोग (Uses)
इसका उपयोग प्रयोगशाला अभिकर्मक के रूप में, जीवाणुनाशी के रूप में तथा औषधियों में ( पूतिरोधी एवं पीड़ाहारी के रूप में) किया जाता है आयोडीन का उपयोग अण्डों के उत्पादन को बढ़ाने में भी किया जाता है। फोटोग्राफी फिल्मों में इसके लवणों का प्रयोग किया जाता है।
अक्रिय गैसें अथवा उत्कृष्ट गैसें (Inert Gases or Noble Gases)
ये हीलियम (He), निऑन (Ne), ऑर्गन (Ar), क्रिप्टॉन (Kr), जेनॉन (Xe) तथा रेडॉन (Rn) हैं। इन्हें आवर्त सारणी के समूह 18 (या शून्य समूह) में रखा गया है। इन्हें अक्रिय गैस कहते हैं क्योंकि ये रासायनिक रूप से अक्रिय हैं। इन्हें उत्कृष्ट गैसें भी कहा जाता है क्योंकि इस परिवार के कुछ सदस्य जैसे Xe, ऑक्सीजन और फ्लुओरीन के साथ यौगिक बनाते हैं अर्थात् ये पूर्णतया अक्रिय नहीं हैं।
रेडॉन के अतिरिक्त अन्य सभी उत्कृष्ट गैसें वायुमण्डल में पाई जाती है ये वायु के द्रवीकरण तत्पश्चात प्रभाजी आसवन के उपोत्पाद के रूप में प्राप्त की जाती है। रेडॉन रेडियम (226) के विघटन उत्पाद के रूप में प्राप्त किया जाता है। ये सभी गैसें एकपरमाणु तत्व हैं। ये गैसें संख्या में अनेकों संयोजन बनाती है, जिनमें ये गैसें कुछ अकार्बनिक और कार्बनकि यौगिकों के क्रिस्टल जालक की कोटरों में फँस जाती है, इन्हें क्लैथरेट या केज (clathrate or cage) यौगिक कहते हैं।
हीलियम (Helium), He
इसकी परमाणु संख्या 2 तथा द्रव्यमान संख्या 4 है तथा इसकी खोज का श्रेय लोकेयर तथा जानसेन को जाता है। यह ब्रह्माण्ड में पाया जाने वाला अतिबहुलता के क्रम में द्वितीय बडा तत्व है। He का मुख्य स्रोत प्राकृतिक गैस है। हीलियम और कभी-कभी निऑन रेडियोधर्मी उत्पत्ति के खनिजों में पाए जाते हैं; उदाहरण पिच ब्लैण्ड, मोनेजाइट, क्लीवाइट। रबड़, काँच तथा प्लास्टिक में से इसका विसरण हो जाता है।
◆ हीलियम-4 हीलियम का समस्थानिक है। इसका अस्तित्व अपने क्वथनांक 4.2K से नीचे तथा अपने लेम्बडा बिन्दु (Lambda point- जिस पर हीलियम-1 (super fluid) हीलियम-2 में परिवर्तित हो जाती है) 2.1768K से ऊपर ताप होता है।
◆ यदि लेम्बडा बिंदु निम्न तथा तापीय चालकता उच्च होती है तो यह विद्यमान होती है। यही कारण है कि बुलबुले उठने के बजाए यह अपनी सतह से सीधे वाष्पित होती है।
◆ चन्द्रमा की सतह पर यह प्रचुरता में पाई जाती है। यह पृथ्वी को ऊर्जा संकट मे डाले रखने की क्षमता रखती है।
उपयोग (Uses)
यह हल्की तथा अज्वलनशील गैस है। अत: इसका उपयोग मौसम प्रेक्षण के लिए गुब्बारों में भरने के लिए किया जाता है। ( अर्थात् मौसम सम्बन्धी जानकरी और एअरक्राफ्ट के टायरों में) गैस शीतित नाभिकीय रिऐक्टरों में भी इसका प्रयोग किया जाता है। द्रव हीलियम को निम्न ताप पर संचालित प्रयोग के लिए निम्नतापी कारक के रूप में किया जाता है। द्रव हीलियम का उपयोग अतिचालक चुम्बक को उत्पन्न तथा कायम रखने के लिए किया जाता है जो NMR स्पेक्ट्रोमीटर तथा MRI तन्त्र के मुख्य अवयव है। आधुनिक गोताखोरी के उपकरणों मे यह ऑक्सीजन के तनुकारी के रूप में उपयोग में आती है क्योंकि रक्त में इसकी विलेयता बहुत कम है। हीलियम और ऑक्सीजन का मिश्रण दमे के मरीजों में कृत्रिम श्वॉस में भी प्रयोग किया जाता है।
निऑन (Neon), Ne
इसकी परमाणु संख्या 10 तथा द्रव्यमान संख्या 20 है। इसकी खोज का श्रेय रैमजे तथा टैवर्ज को जाता है यह द्रव ऑर्गन के वाष्पशील भाग से प्राप्त होती है।
उपयोग (Uses)
इसका उपयोग विसर्जन ट्यूब तथा प्रदीप्त बल्बों में विज्ञापन प्रदर्शन हेतु किया जाता है। निऑन बल्बों का उपयोग वनस्पति उद्यान तथा ग्रीन हाऊस में किया जाता है। निऑन लैम्प हवाई अड्डों पर विमान चालकों को संकेत देने में प्रयुक्त होते हैं, ये लैम्प कोहरे में भी चमकते हैं।
ऑर्गन (Argon), Ar
इसकी खोज एल रैले और रैमजे ने सन् 1892 में वायु से की थी। इसकी परमाणु संख्या 18 तथा द्रव्यमान संख्या 40 है।
उपयोग (Uses)
ऑर्गन का उपयोग मुख्यतय उच्च ताप धातु कर्मीय प्रक्रमों में धातुओं तथा उपधातुओं के आर्क वैल्डिंग में अक्रिय वातावरण उत्पन्न करने में इसका प्रयोग किया जाता है। विद्युत बल्ब में ऑर्गन गैस भरी जाती है।
क्रिप्टॉन (Krypton), Kr
इसका परमाणु क्रमांक 36 और द्रव्यमान संख्या 84 है। इसकी खोज सन् 1898 में रैमजे और ट्रेवर्स ने की थी। यह स्पेक्ट्रम के पीले और हरे क्षेत्र मे अभिलाक्षणिक लाइन उत्पन्न करती है।
उपयोग (Uses)
इसका उपयोग एअरपोर्ट रनवे और एप्रोच लाइट ( पहुँच प्रकाश) में किया जाता है।
जीनॉन (Xenon), Xe
जीनॉन सर्वाधिक यौगिक बनाने वाली अक्रिय गैस है। इसकी परमाणु संख्या 54 तथा द्रव्यमान संख्या 131 है। इसकी खोज रैमजे तथा टैवर्स ने की थी। प्रथम अक्रिय गैस यौगिक XePtF6 नील बर्टलैट ने सन् 1962 में बनाया था। इस खोज के पश्चात् जीनॉन के बहुत से यौगिक फ्लुओरीन एवं ऑक्सीजन तत्वों के साथ संश्लेषित किए गए।
उपयोग (Uses)
जीनॉन, क्रिप्टॉन का उपयोग उच्च तीव्रता फोटोग्राफिक फ्लैश ट्यूब में किया जाता है।
रेडॉन (Radon), Rn
इसकी खोज डोर्न नामक वैज्ञानिक ने की थी इसका उपयोग कैन्सर के उपचार में किया जाता है। (रेडियोथैरेपी अर्थात् विकिरण उपचार में ) ।
उपधातु (Metalloids)
उपधातु (अर्थात् तत्व जिनमें धातु और अधातु दोनों गुण पाए जाते हैं। आवर्त सारणी में इन्हें धातु और अधातुओं के मध्य रखा गया है।) ये संख्या में सात हैं। बोरॉन, सिलिकॉन, आर्सेनिक, एन्टिमनी, जर्मेनियम, टेलुरियम और पोलोनियम (B, Si, As, Sb, Ge, Te तथा Po क्रमश:) है।
बोरॉन कॉस्मिक-रे स्पालेशन द्वारा प्राप्त किया जाता है तथा इसका उपयोग नाभिकीय रिऐक्टरों में नियन्त्रण छड़ो में, बुलेटप्रुफ जैकेट बनाने में, बहुत सी विद्युतीय युक्तियों में अर्द्धचालक के रूप में किया जाता है। बोरेक्स का उपयोग गालक के रूप में, बोरेक्स मनका परीक्षण में, जल के मृदुकरण में प्रतिरोधी के रूप में तथा काँच और पॉटरी उद्योग में किया जाता है।
ऑर्थोबोरिक अम्ल पूतिरोधी के रूप में बोरिक लोशन के नाम से आँखों के लोशन में और भोजन परिरक्षण में प्रयुक्त किया जाता है। इसका उपयोग पाउडर जो कैरम बोर्ड को चिकना बनाने के लिए छिड़के जाते हैं में किया जाता है। बोरॉन कार्बाइड जो कि नॉरबाइड (norbide) नाम से जाना जाता है। सबसे अधिक कठोर कृत्रिम पदार्थ है। ट्राइबोरिन ट्राइएमिन (B3 N3 H6) को अकार्बनिक बेन्जीन या बोराजोल या बोराजीन भी कहते हैं। सिलिकॉन का उपयोग आयरन और ऐलुमिनियम के मिश्रधातु बनाने में किया जाता है। जर्मेनियम और गैलियम आर्सेनाइड अर्द्धचालक के रूप में सोलर सेल, फोटोडायोड, ट्रांजिस्टरों में प्रयोग किए जाते हैं। गैलियम आर्सेनाइड के कम्प्यूटर चिप्स बनाए जाते हैं।
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here