धातुएँ और उनके यौगिक (Metals and Their Compounds)
धातुएँ और उनके यौगिक (Metals and Their Compounds)
धातुएँ और उनके यौगिक (Metals and Their Compounds)
तत्व जो इलेक्ट्रॉन त्यागकर धनायन बनाने की प्रवृत्ति रखते हैं, धातु कहलाते हैं। ये आवर्त सारणी का अधिकांश भाग घेरते हैं। दाएँ कोने को छोड़कर सभी दूसरे तत्व (अर्थात् s, p, d और ƒ-ब्लॉक के तत्व) धातु हैं।
◆ पूर्व ऐतिहासिक काल में केवल तीन धातुएँ कॉपर (Cu), चाँदी (Ag)और सोना (Au) ही ज्ञात थी। लेकिन अब ज्ञात धातुओं की संख्या 90 तक हो गई है।
धातुओं के भौतिक गुण (Physical Properties of Metals)
(i) कक्ष ताप पर मर्करी को छोड़कर सभी धातुएँ ठोस अवस्था में पाई जाती हैं।
(ii) मुक्त इलेक्ट्रॉनों की उपस्थिति के कारण शुद्ध अवस्था में धातुओं में धात्विक चमक होती है। इन्हें पॉलिश किया जा सकता है।
(iii) धातुएँ सामान्यतः कठोर होती हैं (सोडियम, पोटैशियम तथा कैल्सियम को छोड़कर) तथा प्रत्येक कठोरता अलग-अलग होती है। धातु की
(iv) धातुएँ आघातवर्ध्य होती हैं अर्थात् पीटकर इन्हें पतली चादरों में परिवर्तित किया जा सकता है। सोना और चाँदी सबसे अधिक आघातवर्ध्य धातु हैं।
(v) धातुएँ तन्य होती हैं। सोना सबसे अधिक तन्य धातु है। 1 मिली ग्राम सोने से 200 मीटर लम्बा तार खींचा जा सकता है।
(vi) धातुएँ ऊष्मा की सुचालक हैं। सिल्वर और कॉपर ऊष्मा के सबसे अच्छे चालक हैं। इनकी तुलना में लैंड तथा मर्करी ऊष्मा के कुचालक हैं।
(vii) धातुएँ विद्युत की भी सुचालक है। सिल्वर विद्युत की सर्वोत्तम चालक है।
(viii) धातुएँ ध्वानिक (sonorous) होती हैं।
(ix) सोडियम और पोटैशियम को छोड़कर धातुओं के घनत्व उच्च होते हैं।
(x) सामान्यतः धातुओं के गलनांक उच्च होते हैं। गैलियम और सीजियम धातुओं के गलनांक कम होते हैं।
धातुओं के रासायनिक गुण (Chemical Properties of Metals)
(i) धातुएँ प्रकृति में विद्युत धनात्मक होती हैं। अर्थात् इलेक्ट्रॉन त्यागकर धनायन बनाने की प्रवृत्ति रखती हैं। अतः ये अधातुओं जैसे ऑक्सीजन, हाइड्रोजन, क्लोरीन, सल्फर, आदि से शीघ्रता से क्रिया करती हैं।
(ii) धातुओं की ऑक्सीजन से अभिक्रिया (Reaction of Metals with Oxygen)
(a) लगभग सभी धातुएँ ऑक्सीजन के साथ मिलकर संगत धातु के ऑक्साइड बनाती हैं।
धातु + ऑक्सीजन → धातु ऑक्साइड
उदाहरण जब कॉपर को वायु में गर्म किया जाता है तो यह ऑक्सीजन से संयोग करके काला ऑक्साइड, कॉपर (II) ऑक्साइड बनाता है। इसी प्रकार ऐलुमिनियम, ऐलुमिनियम ऑक्साइड बनाता है।
(b) धातु ऑक्साइड क्षारीय प्रकृति (basic in nature) के होते हैं। लेकिन कुछ धातु ऑक्साइड जैसे जिंक ऑक्साइड और ऐलुमिनियम ऑक्साइड अम्लीय और क्षारीय दोनों व्यवहार दर्शाते हैं, अतः ये उभयधर्मी ऑक्साइड (amphoteric oxide) हैं।
(c) अधिकांश धातु ऑक्साइड जल में अविलेय होते हैं। लेकिन जो जल में विलेय हैं वे क्षार ( alkalis) कहलाते हैं।
(iii) धातुओं की जल से अभिक्रिया (Reaction of Metals with Water) धातुएँ जैसे सोडियम, पोटैशियम, कैल्सियम, मैग्नीशियम जल के साथ अभिक्रिया करके धातु हाइड्रॉक्साइड और हाइड्रोजन उत्पन्न करती हैं। ऐलुमिनियम, आयरन और जिंक जैसी धातुएँ भाप से अभिक्रिया करके धातु के ऑक्साइड और हाइड्रोजन उत्पन्न करती हैं। लैड, सिल्वर, कॉपर और गोल्ड जल से अभिक्रिया नहीं करते हैं।
(iv) धातुओं की अम्ल से अभिक्रिया (Reaction of Metals with Acids) धातुएँ तनु अम्ल से अभिक्रिया करके संगत लवण तथा हाइड्रोजन गैस उत्पन्न करती हैं। धातुएँ तनु नाइट्रिक अम्ल के साथ क्रिया करके हाइड्रोजन गैस उत्सर्जित नहीं करती हैं। क्योंकि तनु नाइट्रिक अम्ल एक प्रबल ऑक्सीकारक है। यह धातु के साथ अभिक्रिया में उत्पन्न हाइड्रोजन गैस को जल में ऑक्सीकृत कर देता है तथा स्वयं किसी भी नाइट्रोजन के ऑक्साइड जैसे N2O, NO और NO2 में अपचयित हो जाता है। लेकिन मैग्नीशियम और मैंगनीज अति तनु नाइट्रिक अम्ल से अभिक्रिया करके हाइड्रोजन गैस उत्पन्न करते हैं।
◆ लीथियम सबसे हल्का धात्विक तत्व है जो बहुत प्रबल अपचायक है।
◆ पोटैशियम और सोडियम धातुएँ इतनी तेजी से अभिक्रिया करती हैं कि खुले में रखने पर ये आग पकड़ लेती हैं। इसलिए इन्हें सुरक्षित रखने के लिए इन्हें कैरोसीन तेल में डुबोकर रखा जाता है।
◆ सामान्य ताप पर मैग्नीशियम, ऐलुमिनियम, जिंक, लैड, आदि जैसी धातुओं की सतह पर ऑक्साइड की पतली परत चढ़ जाती है जो धातुओं को पुनः ऑक्सीकरण से सुरक्षित रखती है।
◆ गर्म करने पर आयरन का दहन नहीं होता है लेकिन बर्नर की ज्वाला में लौह चूर्ण डालने पर वह तेजी से जलने लगता है।
◆ सिल्वर और गोल्ड अत्यन्त अधिक ताप पर भी ऑक्सीजन के साथ अभिक्रिया नहीं करते हैं।
◆ बेरीलियम और मैग्नीशियम अपनी उच्च आयनन ऊर्जा के कारण ज्वाला को रंग प्रदान नहीं करते हैं।
(v) धातुओं की अन्य धातु लवणों के विलयन के साथ अभिक्रिया (Reaction of Metals with Solution of other Metal) अभिक्रियाशील धातु अपने से कम अभिक्रियाशील धातु को उसके यौगिक के विलयन या गलित अवस्था से विस्थापित कर देती है।
उदाहरण आयरन + कॉपर सल्फेट (जलीय) → आयरन सल्फेट ( जलीय) + कॉपर ↓
धातुओं की सक्रियता श्रेणी (Activity Series of Metals)
यह वह सूची है जिसमें धातुओं की क्रियाशीलता को अवरोही क्रम में व्यवस्थित किया जाता है। धातुओं की सापेक्ष अभिक्रियाशीलताओं का क्रम इस प्रकार है
K > Na > Ca > Mg > Al > Zn > Fe > Pb> H > Cu > Hg > Ag > Au
(vi) ज्वाला के रंग (Flame Colouration) क्षार धातुएँ तथा क्षारीय मृदा धातुएँ (बेरीलियम और मैग्नीशियम को छोड़कर) और इनके लवण ज्वाला को अभिलाक्षणिक रंग प्रदान करते हैं । यही कारण है कि इनका प्रयोग आतिशबाजी को रंग देने के लिए किया जाता है।

सोडियम और इसके यौगिक (Sodium and Its Compounds)
सोडियम (Sodium), Na
इसकी परमाणु संख्या 11 और द्रव्यमान संख्या 23 है। यह आवर्त सारणी के समूह 1, आवर्त 3 और s-ब्लॉक में स्थित है। इसका इलेक्ट्रॉनिक विन्यास 1s2 , 2s2 2p6, 3s1 होता है।
भू-पर्पटी में भारानुसार सोडियम 2.27% है। उच्च क्रियाशीलता के कारण सोडियम हमेशा संयुक्त अवस्था में पाया जाता है। चिली साल्टपीटर (NaNO3), सोडियम सल्फेट (ग्लॉबर साल्ट, Na2 SO4 10H2O), बोरेक्स (Na2B4O7 · 10H2O) और ब्राइन या साधारण नमक (NaCl) सोडियम के प्रमुख अयस्क हैं।
सोडियम धातु का निष्कर्षण कास्टनर विधि द्वारा गलित सोडियम हाइड्रॉक्साइड के विद्युत अपघटन द्वारा या डाउन विधि द्वारा गलित सोडियम क्लोराइड के विद्युत अपघटन द्वारा किया जाता है।
गुणधर्म (Properties)
(i) यह हल्की, मुलायम, चाँदी की तरह सफेद धातु है, जिसे चाकू से काटा जा सकता है।
(ii) यह उच्च क्रियाशील धातु है अर्थात् नम वायु से क्रिया करके सोडियम ऑक्साइड (Na2O) बनाती है और यह जल से क्रिया करके सोडियम हाइड्रॉक्साइड (NaOH) और हाइड्रोजन गैस बनाती है। इसकी अधिक क्रियाशीलता के कारण इसे कैरोसीन तेल में डुबोकर रखा जाता है।
(iii) यह बेन्जीन में विलेय है।
(iv) यह अमोनिया से क्रिया करके सोडामाइड (NaNH2), अम्लों से अभिक्रिया करके उनके संगत लवण और हाइड्रोजन तथा ऐल्कोहॉल से अभिक्रिया करके सोडियम ऐल्कॉक्साइड (ONa) बनाता है और हाइड्रोजन मुक्त करता है। .
उपयोग (Uses)
(i) अपचायक के रूप में, मिश्रधातु बनाने में तथा एन्टीस्केलिंग कारक के रूप में।
(ii) नाभिकीय रिऐक्टरों में द्रव रूप में शीतलक के रूप में।
(iii) सोडियम-लैड मिश्रधातु से टेट्राएथिल लैड (TEL) नामक अपस्फोटनरोधी बनाने में।
सोडियम के यौगिक (Compounds of Sodium)
1. सोडियम क्लोराइड (Sodium Chloride), NaCl
यह टेबल साल्ट (table salt) या साधारण नमक (common salt) के नाम से जाना जाता है। समुद्री जल में बहुत से लवण घुले होते हैं (जिनमें से 75% NaCl है)। इन लवणों से सोडियम क्लोराइड को वाष्पीकरण की प्रक्रिया द्वारा पृथक् कर लिया जाता है। इसका उपयोग मानव भोजन के मुख्य अवयव के रूप में, हिम मिश्रण (बर्फ के साथ) के रूप में तथा अचार, माँस, मछली के परिरक्षण में तथा प्रतिदिन काम आने वाले विभिन्न पदार्थों जैसे सोडियम हाइड्रॉक्साइड, वाशिंग सोडा, ब्लीचिंग पाउडर आदि के लिए मुख्य कच्चे माल के रूप में किया जाता है।
2. सोडियम हाइड्रॉक्साइड (Sodium Hydroxide), NaOH
इसे साधारणतया कॉस्टिक सोडा (caustic soda) या दाहक सोडा भी कहते हैं। इसका उपयोग साबुनों, अपमार्जकों व लवणों के निर्माण में, pH को नियमित करने में, प्रयोगशाला अभिकर्मक के रूप में, पेट्रोलियम शोधन में, सोडियम के निष्कर्षण में, रंजकों, (चिकना कागज) कागज और कृत्रिम सिल्क (रयॉन) उद्योग में तथा बॉक्साइट खनिज के शोधन में किया जाता है।
3. सोडियम कार्बोनेट (Sodium Carbonate), Na2CO3,
सोडियम कार्बोनेट डेकाहाइड्रेट, Na2CO3 10H2O को सामान्यता वाशिंग सोडा या सोडा क्रिस्टल कहते हैं। निर्जल सोडियम कार्बोनेट सोडा ऐश है। इसका जलीय विलयन क्षारीय है यही कारण है कि इसका उपयोग अपमार्जक के रूप में किया जाता है। इसका उपयोग जल की स्थाई कठोरता दूर करने में और कपड़ों से ग्रीस, चिकनाई और वाइन के धब्बों को साफ करने में काँच, साबुन, बोरेक्स, कॉस्टिक सोडा, जल काँच, कागज, पेन्ट के निर्माण में तथा पेट्रोलियम को शुद्ध करने में और वस्त्र उद्योग में अभिकर्मक के रूप में तथा प्रयोगशाला में अभिकर्मक के रूप में किया जाता है।
4. सोडियम बाइकार्बोनेट (Sodium Bicarbonate), NaHCO3
इसे बेकिंग सोडा (baking soda), कुकिंग सोडा और ब्रेड सोडा के नाम से जाना जाता है। इसका उपयोग सोडा-एसिड अग्निशामकों में, बेकिंग सोड़ा, केक और अन्य भोज्य पदार्थों में किया जाता है।
5. ग्लॉबर साल्ट या सोडियम सल्फेट (Glauber Salt or Sodium Sulphate), Na2SO4 .10H2O
इसका उपयोग जल ग्लास, कागज, दवा तथा अपमार्जक बनाने में किया जाता है। सोडियम सल्फाइड के निर्माण में तथा निर्जलीकारक के रूप में भी प्रयुक्त किया जाता है।
◆ वायु में खुला छोड़ने पर, सोडियम हाइड्रॉक्साइड द्रव हो जाता है और कुछ समय पश्चात् यह सफेद पाउडर में परिवर्तित हो जाता है। क्योंकि NaOH वायु से CO2 का अवशोषण करके Na2CO3 में परिवर्तित हो जाता है। सोडियम कार्बोनट वायु में खुला रखने पर फूल जाता है तथा भुरभुराकर सफेद चूर्ण में परिवर्तित हो जाता है।
◆ सोडियम हाइड्रॉक्साइड को दाहक सोडा कहा जाता है। क्योंकि यह त्वचा और माँस की प्रोटीनों को विखण्डित करके एक पेस्ट जैसा पदार्थ बनाता है।
◆ बेकिंग सोडा जब टार्टरिक अम्ल के साथ मिलाया जाता है तो इसे बेकिंग पाउडर कहते हैं। अभिक्रिया के दौरान उत्पन्न CO2 ब्रेड, केक, आदि को मुलायम और स्पंजी बनाती है। यही कारण है कि इसे बेकिंग सोडा कहते हैं।
6. सोडियम थायोसल्फेट (Sodium Thiosulphate), Na2S2O3 .5H2O
इसे हाइपो (hypo) भी कहा जाता है। यह सोडियम सल्फेट और सल्फर के जलीय विलयन की सोडियम हाइड्रॉक्साइड के साथ अभिक्रिया द्वारा बनाया जाता है। इसका उपयोग फोटोग्राफी में फिल्म के स्थायीकरण में (यह अनअपघटित सिल्वर ब्रोमाइड को विलेयशील सिल्वर थायोसल्फेट लवण के रूप में दूर करता है) सायनाइड विष के विषहर के रूप में, मत्स्यालयों (aquariums) में भरे जाने वाले टोंटी के जल में क्लोरीन दूर करने में (प्रतिक्लोर के रूप में), सिल्वर और गोल्ड के निष्कर्षण में तथा गोलकृमि से बचाव में पैरों को धोने में किया जाता है।
7. माइक्रोकॉस्मिक लवण (Microcosmic Salt), Na(NH4) HPO4 ·4H2O
यह रासायनिक रूप से सोडियम अमोनियम हाइड्रोजन फॉस्फेट है। यह मानव मूत्र में पाया जाता है। गर्म करने पर यह सोडियम मेटाफॉस्फेट और अमोनिया देता है। इसका प्रयोग लवण विश्लेषण में माइक्रोकॉस्मिक लवण मनका परीक्षण में किया जाता है।
मैग्नीशियम और इसके यौगिक (Magnesium and Its Compounds)
मैग्नीशियम (Magnesium), Mg
मैग्नीशियम शब्द ग्रीक शब्द मैग्नीशिया से लिया गया है। इसकी परमाणु संख्या 12 तथा द्रव्यमान संख्या 24 है। यह आवर्त सारणी के समूह 2, आवर्त 3 तथा s- ब्लॉक में स्थित है। इसका इलेक्ट्रॉनिक विन्यास 1s2, 2s22p2,3s2 होता है।
यह धूसर रंग की चमकदार ठोस षट्कोणीय निविड संकुलित (hcp) संरचना वाली धातु है। अपनी उच्च क्रियाशीलता के कारण यह मुक्त अवस्था में नहीं पाई जाती है। यह सामान्यता क्लोराइडों, कार्बोनेटों और सल्फेटों के रूप में पाई जाती है। मैग्नेसाइट (MgCO3), डोलोमाइट (MgCO3. CaCO3), एप्सोमाइट (MgSO4 · 7H2O) व कार्नेलाइट (MgCl2 · KC1 .6H2O) मैग्नीशियम के कुछ मुख्य अयस्क हैं।
मैग्नीशियम का निष्कर्षण मैग्नेसाइट से, मैग्नीशिया के विद्युत अपचयन द्वारा या कार्नेलाइट से, निर्जल मैग्नीशियम क्लोराइड (MgCl2) के विद्युत अपघटन द्वारा किया जाता है। यह पौधों में पाए जाने वाले क्लोरोफिल जो कि पत्तियों के हरे रंग के लिए उत्तरदायी होता है, में पाया जाता है। यह फोटोग्राफी में प्रयुक्त होने वाले फ्लैश बल्बों में पाउडर के रूप में प्रयुक्त किया जाता है।
गुणधर्म (Properties)
(i) यह धूसर (white) रंग की अत्याधिक चमकदार धातु है।
(ii) इसके गलनांक और क्वथनांक क्रमशः 650°C और 1100°C हैं।
(iii) यह आघातवर्ध्य और तन्य धातु है।
(iv) यह तनु अम्लों से अभिक्रिया करके H2 मुक्त करता है लेकिन यह क्षारकों के साथ क्रिया नहीं करता है।
(v) शुष्क ईथर की उपस्थिति में यह एल्किल हैलाइड से अभिक्रिया करके एल्किल मैग्नीशियम हैलाइड देता है, जो निग्नार्ड अभिकर्मक (Grignard’s reagent) के नाम से भी जाना जाता है।
उपयोग (Uses)
(i) फ्लैश लाइट रिबन बनाने में आतिशबाजी में और फोटोग्राफी में |
(ii) मिश्रधातु बनाने में, क्योंकि इसके मिश्रधातु बहुत हल्के और मुलायम होते हैं। इलेक्ट्रॉन (elektron) मैग्नीशियम की मिश्रधातु है इसमें Mg(95%), Zn ( 4.5%), Cu (0.5%) होता है। यह हवाई जहाजों और मोटर वाहनों के ढाँचे बनाने में प्रयुक्त होती है। अपनी उच्च क्रियाशीलता के कारण मैग्नीशियम रिबन को सामान्यता नाइट्रोजन के वातावरण में रखा जाता है।
मैग्नीशियम के यौगिक (Compounds of Magnesium)
1. मैग्नीशियम हाइड्रॉक्साइड (Magnesium Hydroxide), Mg(OH)2
यह सफेद रंग का पदार्थ है जो जल में हल्का विलेय है। मैग्नीशियम हाइड्रॉक्साइड का जल में निलम्बन मिल्क ऑफ मैग्नीशिया (milk of magnesia) कहलाता है। यह एक क्षार है। इसका उपयोग प्रतिअम्ल के रूप में, दस्तावर के रूप में, अपशिष्ट अम्लीय जल को उदासीन करने में, डैन्डर्फ के उपचार में, चूसने वाली गोलियों और कैप्सूल में किया जाता है।
2. मैग्नीशियम सल्फेट (Magnesium Sulphate), MgSO4
यह रंगहीन क्रिस्टलीय ठोस है। यह गर्म झरने के जल में एप्सोमाइट या एप्सम लवण (MgSO4 .7H2O) के रूप में पाया जाता है। यह (ZnSO4 · 7H2O) का समाकृतिक है। यह प्रस्वेद्यन और उत्फुल्लन प्रदर्शित करता है। इसका उपयोग सल्फ्यूरिक अम्ल के निर्माण में उत्प्रेरक के रूप में (प्लेटिनीकृत MgSO4), सिरेमिक, सीमेन्ट तथा माचिस के निर्माण में तथा अग्निरोधी वस्त्र बनाने में, दस्तावर दवा के रूप में, चमड़ा उद्योग में तथा रंगाई में रंगबन्धक के रूप में किया जात है।
3. मैग्नीशियम कार्बोनेट (Magnesium Carbonate), MgCO3
यह प्रकृति में मैग्नेसाइट या डोलोमाइट (MgCO3 · CaCO3) के रूप में पाया जाता है। यह श्वेत ठोस पदार्थ है। यह जल में विलेय है। इसका उपयोग मैग्नीशियम एल्वा में दवा के रूप में तथा प्रतिअम्ल के रूप में किया जाता है।
4. मैग्नीशियम एल्वा (Magnesium Alva). Mg (OH)2 .2MgCO3 .3H2O
यह एक प्रतिअम्ल है जो मानव आमाश्य से अम्लता दूर करने की औषधि के रूप में प्रयुक्त किया जाता है। इसका प्रयोग दाँतों में अपघर्षक के रूप में ( दन्त मंजन में ) तथा प्रसाधन सामग्री में भी किया जाता है।
5. सोरेल सीमेन्ट (Sorel Cement), MgCl2 · 5MgO·nH2O
इसका उपयोग दाँतों को भरने में काँच और चीनी मिट्टी के बर्तनों को दृढ़ बनाने में किया जाता है।
कैल्सियम और इसके यौगिक (Calcium and Its Compounds)
कैल्सियम (Calcium), Ca
इसकी परमाणु संख्या 20 तथा द्रव्यमान संख्या 40 है। इसे सर्वप्रथम हम्फ्री डेवी (Humphry Davy) ने सन् 1808 में अलग किया था। यह भू-पर्पटी में पाया जाने वाला तीसरा अतिबाहुल्य तत्व है। यह मिट्टी, पौधे, अस्थियों और अण्डों के छिलकों में पाया जाता है।
यह आवर्त सारणी के समूह 2, आवर्त 4 तथा s ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास 1s2 , 2s2 2p6, 3s2 3p6, 4s2 होता है ।
सामान्यता यह संयुक्त अवस्था में पाया जाता है। कैल्सियम के कुछ प्रमुख आयस्क हैं मार्वल चॉक, लाइम (CaCO3), जिप्सम (CaSO4 2H2O), डोलोमाइट (CaCO3 MgCO3), फ्लोरस्पार (CaF2) और फॉस्फोराइट Ca3 (PO4), आदि। इसका निष्कर्षण गलित CaCl2 (85%) तथा CaF2 (15%) के मिश्रण में विद्युत अपघटन द्वारा किया जाता है। CaF2 को तापमान बनाए रखने के लिए तथा निर्जल CaCl2 के गलनांक को कम करने के लिए मिलाया जाता है। सॉल्वे प्रक्रम में CaCl2 एक उपोत्पाद (by-product) के रूप में प्राप्त होता है।
गुण (Properties)
(i) यह चाँदी की भाँति सफेद, चमकदार, नरम (परन्तु सीसे की अपेक्षा कड़ी) धातु है।
(ii) इसका गलनांक 1115 K तथा क्वथनांक 1757 K है। इसका आपेक्षिक घनत्व 1.55 होता है।
(iii) यह अम्लों और जल के साथ हाइड्रोजन गैस देता है लेकिन क्षारकों के साथ नहीं।
उपयोग (Uses)
(i) परिशुद्ध ऐल्कोहॉल के निर्माण में शुष्क कारक (जल को हटाने में) के रूप में।
(ii) उच्च निर्वात उत्पन्न करने के लिए अल्प मात्रा में शेष वायु को हटाने में।
(iii) कास्ट आयरन, स्टील और कॉपर को विऑक्सीकृत करने में ।
(iv) क्रोमियम, थोरियम, आदि के लिए अपचायक के रूप में।
कैल्सियम के यौगिक (Compounds of Calcium)
1. कैल्सियम ऑक्साइड या क्विक लाइम (Calcium Oxide or Quicklime), CaO
यह सफेद, सरन्ध्र ठोस है जो कि जल में शीघ्रता से विलेय होकर कैल्सियम हाइड्रॉक्साइड देता है। जब यह पानी में घुलता है तो सीसी की ध्वनि ( hissing sound) उत्पन्न करता है। इसका उपयोग सीमेन्ट, मोर्टार, ब्लीचिंग पाउडर, काँच और क्षारों के निर्माण में, चीनी के शोधन में, रंजकों तथा अन्य रसायनों के उत्पादन में, अमोनिया और ऐल्कोहॉल के लिए शुष्क कारक के रूप में तथा आयरन के निष्कर्षण में गालक के रूप में तथा लाइम प्रकाश उत्पन्न करने में किया जाता है।
2. कैल्सियम हाइड्रॉक्साइड या बुझा चूना (Calcium Hydroxide or Slaked Lime), Ca(OH)2
इसका निर्माण बिना बुझा चूने में जल मिलाकर किया जाता है। यह श्वेत पाउडर है जल में अल्प विलेय है इसका जलीय विलयन चूने का जल (lime water) कहलाता है तथा बुझे चूने का निलम्बन चूने का दूध (milk of lime) कहलाता है। इसका उपयोग मोर्टार, काँच, ब्लीचिंग पाउडर (क्लोरीन गैस को शुष्क बुझे चूने पर प्रवाहित करने पर) के निर्माण तथा सफेदी में प्राथमिक पदार्थ के रूप में किया जाता है।
◆ सीमित मात्रा में जल मिलाने पर चूने के पिण्डक टूट जाते हैं और बुझे चूने में परिवर्तित हो जाते हैं। इस प्रक्रिया को चूना बुझाने की प्रक्रिया (slaking of lime) कहते हैं। बिना बुझे चूने को जब सोडा द्वारा बुझाया जाता है तब सोडा लाइम प्राप्त होता है।
3. कैल्सियम कार्बोनेट (Calcium Carbonate), CaCO3
प्रकृति में यह मार्बल, चूना-पत्थर, खड़िया, आदि के रूप में पाया जाता है। डोलोमाइट के रूप में यह मैग्नीशियम कार्बोनेट के साथ पाया जाता है। यह श्वेत रवेदार पाउडर है जो लगभग जल में अविलेय है। उच्च ताप (1200 K) पर यह अपघटित होकर CO2 मुक्त करता है। इसका उपयोग संगमरमर के रूप में भवन निर्माण में, Fe के निष्कर्षण में, CaCO3 का MgCO3 के साथ मिश्रण का प्रयोग गालक (flux) के रूप में, प्रसाधनों में फिलर के रूप में और कागज उद्योग में उच्च गुणवत्ता का कागज बनाने में किया जाता है।
4. कैल्सियम क्लोराइड (Calcium Chloride), CaCl2
यह अल्प मात्रा में समुद्री जल में भी पाया जाता है। यह रंगहीन क्रिस्टलीय ठोस पदार्थ है यह जल और ऐल्कोहॉल दोनों में विलेय है। इसके एक अणु में 6 अणु क्रिस्टलन जल के होते हैं। यह प्रकृति में प्रस्वेदी तथा आर्द्रताग्राही होता है। इसका उपयोग शुष्ककारक के रूप में या जल अवशोषक पदार्थ के रूप में डिब्बा बन्द पदार्थों की शुष्कता को सुनिश्चित करने के लिए किया जाता है। इसका प्रयोग ऐल्कोहॉल और अमोनिया को शुष्क करने में नहीं किया जाता है क्योंकि यह इनके साथ योगात्मक उत्पाद बनाता है।
5. विरंजक चूर्ण (Bleaching Powder), Ca(OCl)Cl
इसका रासायनिक नाम कैल्सियम ऑक्सीक्लोराइड है। यह सफेद चूर्ण होता है। जिसमें से क्लोरीन की गन्ध आती रहती है। इसका उपयोग विसंक्रामी, कीटाणुनाशी, कीटनाशी के रूप में, जल के शोधन में, कपड़ा, कागज व जूट उद्योग में विरंजक के रूप में तथा ऊन को सिकुडन रहित बनाने में किया जाता है।
6. जिप्सम ( Gypsum), CaSO4 · 2H2O
कैल्सियम सल्फेट को जिप्सम कहते हैं यह श्वेत रवेदार ठोस है इसके एक अणु में जल के दो अणु क्रिस्टलन जल के रूप में होते हैं। इसका उपयोग प्लास्टर ऑफ पेरिस तथा अमोनियम सल्फेट (NH4)2SO4 खाद बनाने में किया जाता है।
यह रासायनिक रूप से कैल्सियम सल्फेट हेमी (अर्द्ध) हाइड्रेट है यह जल में अविलेय है। इसे जिप्सम को 120°C पर गर्म करके प्राप्त किया जाता है। जब प्लास्टर ऑफ पेरिस जल के सम्पर्क में आता है तो जलयोजन के कारण यह अन्य हाइड्रेट में परिवर्तित हो जाता है और जमकर कठोर और ठोस हो जाता है। यह प्रक्रिया प्लास्टर ऑफ पेरिस का जमना कहलाती है।
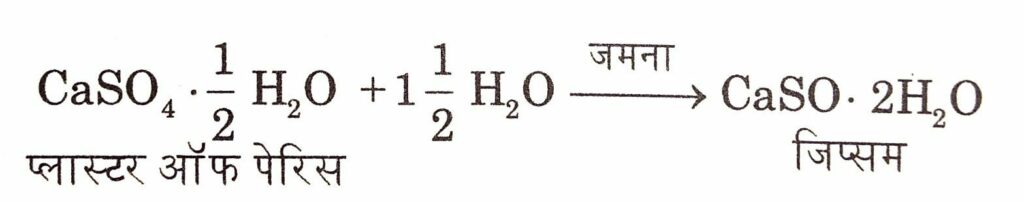
क्योंकि उपरोक्त अभिक्रिया ऊष्माक्षेपी है। अतः अभिक्रिया मिश्रण का ताप बढ़ जाता है। इसका उपयोग टूटी अस्थियों के प्लास्टर में तथा दन्त चिकित्सा में, मूर्तियाँ, खिलौने और अलंकरण कार्य करने में किया जाता है।
8. सुपरफॉस्फेट ऑफ लाइम (Superphosphate of Lime), CaH4 (PO4 )2 + CaSO4.2H2O
यह कैल्सियम हाइड्रोजन फॉस्फेट और कैल्सियम सल्फेट का मिश्रण है। इसके फॉस्फोराइट खनिज तथा जानवरों की हड्डियों से बनाया जाता है। यह जल में विलेय है। इस कारण पौधें इसे आसानी से समावेशित कर लेते हैं। इसका उपयोग उर्वरक के रूप में फसल उत्पादन की वृद्धि में किया जाता है।
◆ नाइट्रोलिम (CaCN2), कैल्सियम कार्बाइड को नाइट्रोजन के साथ 2000°C पर गर्म करके प्राप्त किया जाता है।
◆ हाइड्रोलिथ (hydrolith), CaH2 का उपयोग H2 गैस के शीघ्र पूर्तिकर्ता के रूप में किया जाता है क्योंकि यह जल से क्रिया कर हाइड्रोजन गैस देता है।
◆ कैल्सियम फॉस्फेट, Ca3 (PO4)2 का प्रयोग टूथपेस्ट में किया जाता है।
ऐलुमिनियम और इसके यौगिक (Aluminium and Its Compounds)
ऐलुमिनियम (Aluminium), Al
यह चाँदी के समान सफेद, मुलायम तथा तन्य धातु है। इसकी परमाणु संख्या 13 तथा द्रव्यमान संख्या 27 होती है। यह आवर्त सारणी के समूह 13, आवर्त 3 तथा p-ब्लॉक में स्थित है। इसका इलेक्ट्रॉनिक विन्यास 1s2, 2s2 2p6, 3s2 3p1 होता है।
यह भू-पर्पटी में पाया जाने वाला तत्व है। यह मुक्त अवस्था में नहीं पाया जाता है। संयुक्त अवस्था में यह बॉक्साइट (Al2O3 · 2H2O), कोरण्डम (Al2O3), फेल्सपार (K2O. Al2O3 · 6SiO2) और क्रायोलाइट (Na3 AlF6) के रूप में पाया जाता है। इसका मुख्य अयस्क बॉक्साइट या हाइड्रेटिड ऐलुमिना है। यदि इसमें प्रमुख अशुद्धि Fe2O3 है तो यह बॉयर (Baeyer’s) प्रक्रम या हॉल (Hall’s) के प्रक्रम द्वारा सान्द्रित किया जाता है तथा प्रमुख अशुद्धि SiO2 होने पर इसे सर्पेक (Serpek’s) प्रक्रम द्वारा सान्द्रित किया जाता है। विद्युत अपघटन द्वारा ऐलुमिनियम के निष्कर्षण में ऐलुमिना में क्रायोलाइट और फ्लुओरस्पार मिलाने पर ऐलुमिना का गलनांक कम हो जाता है। ऐलुमिनियम का शोधन हूप की विद्युत अपघटन विधि (Hoope’s electrolytic method) द्वारा किया जाता है।
गुण (Properties)
(i) यह चाँदी जैसी सफेद चमकदार धातु है इसका गलनांक और क्वथनांक क्रमशः 659.8°C तथा 2200°C है।
(ii) यह ऊष्मा तथा विद्युत का अच्छा चालक है।
(iii) इसका घनत्व 2.7 ग्राम सेमी-3 है ।
(iv) यह तनु HCl और तनु H2SO4 के साथ हाइड्रोजन गैस मुक्त करता है। लेकिन सान्द्र H2SO4 के साथ SO2 देता है।
(v) यह क्षारों जैसे NaOH तथा KOH से अभिक्रिया करके ऐलुमिनेट लवणों के निर्माण के साथ H2 मुक्त करता है।
(vi) यह नाइट्रोजन के साथ ऐलुमिनियम नाइट्राइड देता है।
उपयोग (Uses)
(i) धातु कर्मिक प्रक्रमों में अपचायक के रूप में।
(ii) पतली पन्नी (वर्क) के रूप में मिठाइयों को सजाने में, सिगरेटों की पैकिंग में।
(iii) सिल्वर पेन्ट के मुख्य अवयव के रूप में, जो लिनसिड (linseed oil) तेल में ऐलुमिनियम पाउडर से बना है।
(iv) मिश्रधातु बनाने में, जो हल्का होने के कारण हवाई जहाजों के निर्माण में प्रयुक्त की जाती है।
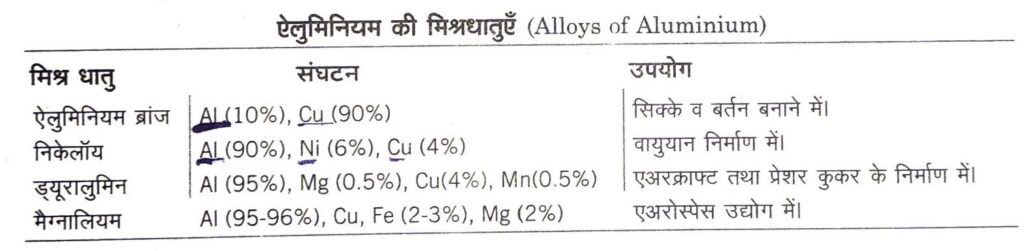
एलुमीनियम के यौगिक (Compounds of Aluminium)
ऐलुमिनियम क्लोराइड (Aluminium Chloride), AlCl3
निर्जल ऐलुमिनियम क्लोराइड एक सफेद प्रस्वेघी ठोस है जो वायु में धूम देता है। इसका उपयोग पेट्रोलियम के शोधन में, संश्लेषित बहुलकों और रबर के उत्पादन में, गैसोलिन के उत्पादन तथा फ्रीडेल-क्राफ्ट अभिक्रिया में उत्प्रेरक के रूप में तथा कठोरी कारक और प्रतिस्वेदी के रूप में किया जाता है।
◆ ऐलुमिनियम कार्बाइड (Al4C3) मेथेनाइड (methanide) नाम से जाना जाता है जो जल से अभिक्रिया करके CH4 (मेथेन) गैस बनाता है।
◆ ऐलुंमिनियम ऐसीटेट को लाल शराब red liquor के नाम से जाना जाता है यह कपड़ों की रंगाई में रंग बन्धक के रूप में तथा कैलिकों छपाई में प्रयुक्त किया जाता है।
मैंगनीज और इसके यौगिक (Manganese and Its Compounds)
मैंगनीज (Manganese), Mn
अतिउच्च शुद्ध मैंगनीज चाँदी जैसी सफेद धातु है लेकिन व्यापारिक नमूना गुलाबीपन लिए होता है। उसकी परमाणु संख्या 25 तथा द्रव्यमान संख्या 55 है। यह आवर्त सारणी के समूह 7, आवर्त 4 और d-ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास [Ar] 3d5, 4s2 होता है।
इसका निष्कर्षण पाइरोलुसाइट अयस्क से कार्बन अपचयन द्वारा या ऐलुमिनो थर्मिक प्रक्रम द्वारा किया जाता है। शुद्ध मैंगनीज जलीय MnSO4 के विद्युत अपघटन द्वारा प्राप्त की जाती है। (MnO2 और Mn3O4 को सर्वप्रथम MnSO4 में परिवर्तित करते हैं।)
मैंगनीज के यौगिक (Compounds of Manganese)
मैंगनीज की मिश्रधातु (Alloys of Manganese)
स्पीगेलसन मैंगनीज का मिश्र धातु है इसके संघटक अवयव Mn, Fe और C हैं। इसका उपयोग स्टील के निर्माण में किया जाता है। फेरोमैंगनीज 70-80% Mn (आयरन के साथ) होता है।
पोटैशियम परमैंगनेट (Potassium Permanganate), KMnO4
यह परमैंगनिक अम्ल (HMnO4) का पोटैशियम लवण है। यह MnO2 (पाइरोलुसाइट) को KOH के साथ संगलित करने के पश्चात् विद्युत अपघटनी ऑक्सीकरण द्वारा प्राप्त किया जाता है। यह गहरे बैंगनी रंग का समचतुर्भज, प्रिज्मी (समपा) क्रिस्टलीय ठोस है। यह जल में साधारण विलेय है तथा इसकी विलेयता ताप बढ़ने के साथ बढ़ती है। इसका जलीय विलयन लाल रंग का होता है। यही कारण है कि इसे लाल दवा कहा जाता है। यह KClO4 के साथ समसंरचनात्मकता दर्शाता है। 200°C पर गर्म करने पर यह ऑक्सीजन देता है। इसका उपयोग प्रयोगशाला और उद्योगों में ऑक्सीकारक के रूप में, विसंक्रामक तथा कीटाणुनाशक के रूप में (जल के लिए) लाल दवा के नाम से, Fe2+ और C2O42- के आकलन में, रेडॉक्स अनुमापन में, प्रयोगशाला में CI2 के निर्माण में, तेलों को रंगहीन बनाने में, असंतृप्तता (द्विआबन्ध या त्रिआबन्ध की उपस्थिति) की जाँच में, ऊन, सिल्क तथा सूती वस्त्रों के लिए विरंजक के रूप में किया जाता है।
आयरन और इसके यौगिक (Iron and Its Compounds)
आयरन ( Iron), Fe
यह सर्वाधिक उपयोगी धातु है। इसकी खोज 5000 BC पूर्व की गई थी। इसका परमाणु क्रमांक 26 तथा द्रव्यमान संख्या 56 है। यह आवर्त सारणी के समूह 8, आवर्त 4 तथा d-ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास 1s2, 2s2 2p6, 3s2 3p6 3d6, 4s2 होता है।
यह भू-पर्पटी में सबसे अधिक पाया जाने वाला चौथा तत्व (लेकिन दूसरी धातु) है। यह हरी सब्जियों में प्रचुरता से तथा रक्त के हीमोग्लोबिन में पाया जाता है। यह केवल संयुक्त अवस्था में लाल हेमेटाइट (Fe2O3), ब्राउन हेमेटाइट (2Fe2O3 · 3H2O), मेगनेटाइट (Fe3O4), आदि में पाया जाता है। मूलतः लोहे का निष्कर्षण हेमेटाइट अयस्क से वात्या भट्टी में कार्बन अपचयन प्रक्रम द्वारा किया जाता है।
गुण (Properties)
(i) यह अनुचुम्बकीय है (चुम्बक द्वारा आकर्षित हो जाता है)। यह धात्विक चमक लिए धूसर रंग का तत्व है।
(ii) इसका गलनांक और क्वथनांक क्रमश: 1533°C और 2450°C है।
(iii) यह शुष्क वायु तथा जल से क्रिया नहीं करता है। लेकिन लाल तप्त आयरन पर भाप प्रवाहित करने पर H, गैस उत्पन्न करता है।
(iv) यह ठण्डा व तनु HNO3 से क्रिया करके फेरस नाइट्रेट और अमोनियम नाइट्रेट बनाता है।
(v) गर्म सान्द्र H2SO4 से क्रिया करके यह फेरस तथा फेरिक सल्फेट तथा SO2 गैस बनाता है जबकि ठण्डे और सान्द्र HNO3 के साथ यह फेरिक नाइट्रेट और नाइट्रोजन डाइऑक्साइड बनाता है।
(vi) यह हैलोजन और सल्फर के साथ उपचारित करने पर क्रमश: हैलाइड और सल्फाइड देता है।
आयरन की निष्क्रियता (Passivity of Iron)
अति सान्द्र नाइट्रिक अम्ल लोहे से क्रिया करके उसकी सतह पर आयरन ऑक्साइड (Fe3O4) की परत बना देता है जो आयरन को निष्क्रिय बना देता है। निष्क्रिय लोहे को H2 गैस के प्रवाह में गर्म करने पर पुनः सक्रिय लोहे में परिवर्तित किया जा सकता है।
आयरन की कमी से एनीमिया तथा इसकी अधिकता से सिड्रोसिस नामक बिमारी हो जाती है।
आयरन की किस्में (Varieties of Iron)
(i) कच्चा लोहा या पिग आयरन ( Pig Iron) वात्या भट्टी से प्राप्त लोहे में लगभग 4% कार्बन तथा अन्य अशुद्धियाँ जैसे S, P, Si, Mn सूक्ष्म मात्रा में उपस्थित रहती हैं।
(ii) ढलवाँ लोहा (Cast Iron) इसे कच्चे लोहे को रद्दी लोहे, एवं कोक के साथ गर्म हवा के झोंकों द्वारा पिघलाकर बनाया जाता है। इसमें थोड़ा कम कार्बन लगभग 3% होता है। यह अति कठोर या भंगुर होता है। इसका उपयोग ढलाई में, रेल की पटरी, गर्म जल के पाइप, पात्र (बर्तन), टाईप राइटर कवर, बिजली के खम्भे (जहाँ खिचाव कम से कम होता है) बनाने में किया जाता है। इसका उपयोग स्टील और पिटवाँ लोहा बनाने में भी किया जाता है।
(iii) पिटवाँ लोहा (Wrought Iron) यह वाणिज्यिक लोहे का शुद्धतम् रूप है। इसमें 0.12 से 0.25% कार्बन होता है। इसे हेमाटाइट की परत चढ़ी हुई परावर्तनी भट्टी में ढलवाँ लोहे की अशुद्धियों को ऑक्सीकृत करके बनाया जाता है। चूने का पत्थर गालक के रूप में मिलाया जाता है। यह आघातवर्ध्य, कठोर, तन्य और उच्च चुम्बकीय परिगम्यता वाला है। इसका उपयोग चेन, हुक, कीलें, बोल्ट, तार तथा छड़ें बनाने में किया जाता है।
(iv) इस्पात (Steel) यह आयरन और कार्बन की मिश्रधातु हैं। साधारणतया इसे ढलवाँ लोहे से तीन प्रक्रमों, बेसेमर प्रक्रम, LD प्रक्रम और खुली भट्टी प्रक्रम द्वारा बनाया जाता है। स्टील निर्माण के दौरान स्पीगेलसन मिलाया जाता है। स्टील में कार्बन 0.25-1.5% तक होता है। कार्बन की मात्रा के आधार पर स्टील की बहुत सी किस्में जैसे मृदु इस्पात, मध्य इस्पात, कठोर इस्पात और मिश्रधातु इस्पात आदि होती हैं।
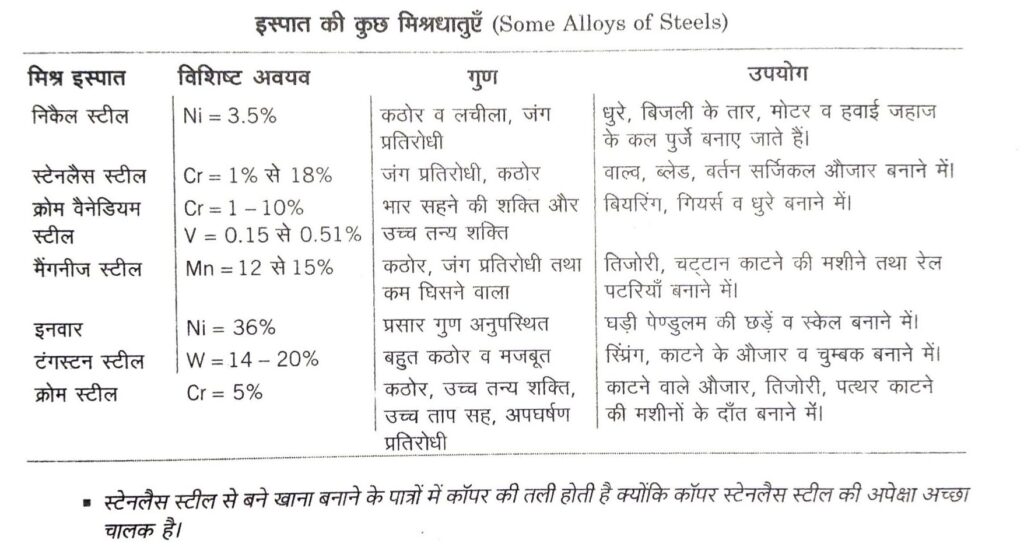
इस्पात का तापीय उपचार (Heat Treatment of Steel)
इस्पात के तापीय उपचार निम्न हैं
(i) तापानुशीतन (Annealing) इस प्रक्रिया में इस्पात को रक्त तप्त गर्म करके धीरे-धीरे ठण्डा करते हैं। इस प्रकार प्राप्त इस्पात नरम और तन्य होता है।
(ii) द्रुत शीतलन (Quenching) इस प्रक्रिया में इस्पात को रक्त तप्त गर्म करके अचानक जल या तेल में डुबाकर ठण्डा करते हैं जिससे यह बहुत कठोर और भंगुर हो जात है।
(iii) पानी चढ़ना ( Tempering) इस प्रक्रिया में द्रुत शीतलित इस्पात को लालतप्त ताप से काफी कम ताप पर गर्म करते हैं तथा धीरे-धीरे ठण्डा करते हैं। इस प्रकार प्राप्त इस्पात न तो बहुत कठोर होता है और न ही भंगुर । इस प्रक्रिया के दौरान इस्पात की सतह पर ऑक्साइड की एक पतली परत चढ़ जाती है।
इस्पात का सतही उपचार (Surface Treatment of Steel)
इस्पात के सतही उपचार में निम्न दो पद हैं
(i) कठोरीकरण (Case Hardening) मृदु इस्पात (mild steel) को चारकोल के साथ गर्म करते हैं तत्पश्चात इसे टूट-फूट प्रतिरोधी बनाने के लिए इसे तेल में डुबा देते हैं।
(ii) नाइट्राइडिंग (Nitriding) इस प्रक्रिया में इस्पात को शुष्क अमोनिया के वातावरण में 500-600°C ताप पर 3 से 4 दिन तक गर्म करते हैं। सतह पर आयरन नाइट्राइड की कठोर परत बन जाती है।
आयरन के यौगिक (Compound of Iron)
फेरस सल्फेट (Ferrous Sulphate) FeSO4 7H2O
सजल फेरस सल्फेट (FeSO4 7H2O) को हरा कसीस (green vitriol) भी कहते हैं। यह हरा क्रिस्टलीय ठोस है जो जल में शीघ्र विलेय है। इसका उपयोग लौहयुक्त दवा बनाने में नीली-काली स्याही मोहर लवण तथा अन्य यौगिक बनाने में, रंग उद्योग में रंग बन्धक के रूप में, कृषि में कीटनाशक के रूप में किया जाता है।
आयरन ऑक्साइड (Iron Oxide) FeO and Fe2O3
आयरन दो प्रकार के ऑक्साइड बनाता है; फेरस ऑक्साइड (FeO) और फेरिक ऑक्साइड (Fe2O3)। वाद वाले ऑक्साइड को Jeweller’s rauge भी कहते हैं।
मोहर लवण (Mohr’s Salt), FeSO4 (NH4) 2SO4 · 6H2O
इसका रासायनिक नाम फेरस अमोनियम सल्फेट है। यह हल्के रंग का क्रिस्टलीय द्विक लवण है। इसे फैरस सल्फेट और अमोनियम सल्फेट के संतृप्त जलीय विलयनों (वायु मुक्त आसुत जल में बने संतृप्त विलयन) के मिलाने पर प्राप्त किया जाता है। मोहर लवण जल में विलेय किन्तु ऐल्कोहॉल में अविलेय है। इसका उपयोग अपचायक के रूप में, चमड़े की रंगाई में, नीली स्याही और कीटनाशकों के निर्माण में कपड़ा उद्योग में वस्त्रों की रंगाई में, प्रयोगशाला में आयतनी विश्लेषण तथा रंगीन क्षार मूलकों के परीक्षण में किया जाता है।
कॉपर और इसके यौगिक (Copper and Its Compounds)
कॉपर (Copper), Cu
यह एक संक्रमण तत्व है तथा सिल्वर और गोल्ड के साथ सिक्का धातु या मुद्रा धातु कहलाता है क्योंकि इनका उपयोग सिक्के बनाने में होता है। यह दूसरी सर्वाधिक उपयोग में लाई जाने वाली धातु है। इसका परमाणु क्रमांक 29 तथा द्रव्यमान संख्या 63.54 है। इसका नाम 9000 BC में रोमन काल में साइप्रस नामक खनन स्थान के नाम पर रखा गया। यह आवर्त सारणी के समूह 11 ( या IB), आवर्त 4 और d-ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास [Ar]3d10 4s1 होता है।
यह मुक्त तथा संयुक्त दोनों रूपों में पाया जाता है। इसका निष्कर्षण मुख्यता कॉपर पायराइट (CuFeS2) तथा कॉपर ग्लांस (Cu2S) से स्वतः अपचयन प्रक्रम द्वारा किया जाता है।
गुण (Properties)
(i) यह लाल नारंगी रंग की धात्विक चमक लिए धातु है।
(ii) यह आद्यातवर्ध्य, तन्य, ऊष्मा और विद्युत की अच्छी सुचालक है।
(iii) इसका गलनांक तथा क्वथनांक क्रमशः 1083°C तथा 2310°C है।
(iv) इसक घनत्व 8.95 ग्राम सेमी-3 है।
(v) यह शुष्क वायु से कोई क्रिया नहीं करता है लेकिन नम वायु से क्रिया करके यह बेसिक कॉपर कार्बोनेट (हरी परत) बनाता है।
(vi) यह तनु तथा ठण्डे HCl तथा H2SO4 दोनों से क्रिया नहीं करता है।
(vii) यह सान्द्र H2SO4 के साथ SO2 देता है, तनु HNO3 के साथ N2O (नाइट्रस ऑक्साइड), 50% HNO3 के साथ यह NO (नाइट्रिक ऑक्साइड) तथा सान्द्र HNO3 के साथ यह NO2 गैस बनाता है। गर्म कॉपर के ऊपर HNO3 वाष्पों को प्रवाहित करने पर N2 गैस बनती है।
उपयोग (Uses)
(i) विद्युत लेपन तथा विद्युत मुद्रण में
(ii) विद्युत तार, विद्युत उपकरण, कैलोरीमापी तथा घरेलू बर्तन बनाने में।
(iii) सिक्के और मिश्रधातु बनाने में ।
(iv) सभी सजीवों में आवश्यक तत्व के रूप में। यह श्वसन एन्जाइम कॉम्पलेक्स, साइटोक्रोम C ऑक्सीडेज का मुख्य अवयव है।
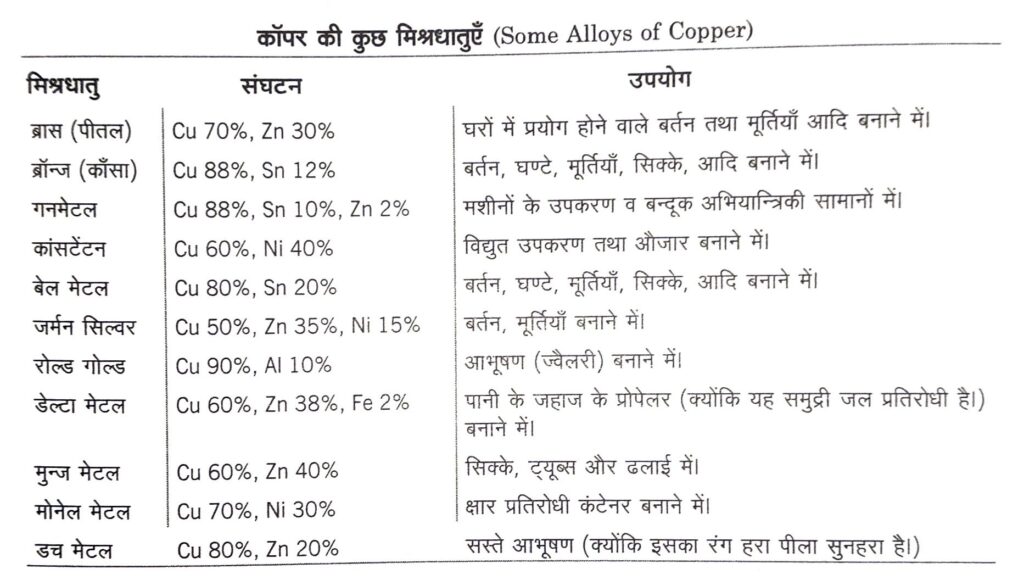
कॉपर के यौगिक (Compounds of Copper)
कॉपर (II) सल्फेट (Copper Sulphate), CuSO4
यह पीत हरा या मटमैला (धूसर ) सफेद रंग का चूर्ण है। सजल कॉपर सल्फेट (CuSO4 5H2O) नीले रंग का यौगिक है तथा नीला थोथा या नीला कसीस (blue vitriol) नाम से जाना जाता है। यही कारण है कि निर्जल कॉपर सल्फेट जल की उपस्थिति के परीक्षण में उपयोग किया जाता है। इसका जलीय विलयन प्रकृति में अम्लीय है यह विषैला होता है। इसका उपयोग परजीवियों से ग्रसित मत्स्यालयों की मछलियों के उपचार में, कृषि में कवकनाशी तथा जर्मनाशी के रूप बोर्डेक्स मिश्रण में, बागवानी में नंवाकुरो को नमी से बचाने में चेस् नट यौगिक (chestnut compound) के रूप में, विद्युत लेपन तथा विद्युत सेलों में, अशुद्ध कॉपर के शोधन में तथा हरे रंजक बनाने में किया जाता है।
फेहलिंग विलयन (Fehling’s Solution )
यह दो विलयनों का मिश्रण हैं फेहलिंग विलयन A और फेहलिंग विलयन BI फेहलिंग विलयन A, कॉपर सल्फेट तथा फेहलिंग विलयन B, सोडियम पोटैशियम टार्टरेट का क्षारीय विलयन है। यह विलयन ऐल्डिहाइडों या मोनोसेकैराइडों जैसे ग्लूकोस के साथ उपचारित करने पर Cu2O का लाल अवक्षेप देता है। यह इन यौगिकों (ऐल्डिहाइड और मोनोसैकेराइडों जैसे ग्लूकोस) की उपस्थिति ज्ञात करने में प्रयुक्त किया जाता है।
सिल्वर और इसके यौगिक (Silver and Its Compounds)
सिल्वर (Silver), Ag
सिल्वर नरम, सफेद, चमकदार संक्रमण धातु है। इसकी परमाणु संख्या 47 तथा द्रव्यमान संख्या 108 है। यह आवर्त सारणी के समूह 11, आवर्त 5 और d ब्लॉक में स्थित है। इसका इलेक्ट्रॉनिक विन्यास 1s2, 2s2 2p6, 3s2 3p6 3d10, 4s2 4p6 4d10, 5s1 होता हैं।
चाँदी प्रकृति में मुक्त और संयुक्त दोनों अवस्थाओं में मिलती है। चाँदी के मुख्य अयस्क अर्जेण्टाइट या सिल्वर ग्लांस (Ag2S), हॉर्न सिल्वर (AgCI) और रुबी सिल्वर या पाइरारगाइराइट (3 Ag2S. Sb2S3) हैं।
चाँदी का निष्कर्षण मुख्यतः मैक आर्थर सायनाइड प्रक्रम द्वारा अर्जेण्टाइट अयस्क से किया जाता है। यद्यपि व्यापारिक स्तर पर इसे सोने के निष्कर्षण के दौरान उपोत्पाद के रूप में प्राप्त किया जाता है।
गुण (Properties)
(i) यह उच्च तन्यता और आघातवर्ध्यता वाला चमकदार सफेद ठोस
(ii) इसका गलनांक और क्वथनांक क्रमश: 960°C और 1955°C है यद्यपि इसका आपेक्षिक घनत्व केवल 10.47 है।
(iii) यह ऊष्मा और विद्युत का सर्वश्रेष्ठ चालक है।
(iv) यह शुष्क तथा H2S मुक्त वायु से कोई क्रिया नहीं करती है लेकिन यदि H2S उपस्थित है तो यह काले रंग के सिल्वर सल्फाइड के बनने के कारण काली पड़ जाती है।
(v) यह अम्लों और क्षारों के प्रति अक्रिय है लेकिन ऑक्सीजन की उपस्थिति में NaCN विलयन में घुलकर विलेय संकर सोडियम अर्जेण्टोसायनाइड देता है।
(vi) यह तनु सल्फ्यूरिक अम्ल के प्रति अक्रिय है लेकिन सान्द्र H2SO4 के साथ SO2 मुक्त करती है। यह तनु और सान्द्र (HNO3) नाइट्रिक अम्ल के साथ क्रमश: NO और NO2 गैस बनाती है।
उपयोग (Uses)
(i) सिक्के, बर्तन, आभूषण बनाने में।
(ii) मिश्रधातु रूप में दाँतों के छिद्र भरने में।
(iii) सिल्वर लेपन में ।
सिल्वर के यौगिक (Compounds of Silver)
सिल्वर हैलाइड (Silver Halides)
सिल्वर हैलोजनों से क्रिया करके सिल्वर हैलाइड जैसे सिल्वर क्लोराइड, सिल्वर ब्रोमाइड और सिल्वर आयोडाइड देती है। AgBr फोटोग्राफी में प्रयुक्त होता है, AgCl फोटोक्रोमेटिक काँच बनाने में प्रयुक्त होता है तथा AgI कृत्रिम वर्षा उत्पन्न करने में प्रयुक्त किया जाता है।
सिल्वर नाइट्रेट या लूनॉर कॉस्टिक (Silver Nitrate or Lunar Caustic), AgNO3
यह सिल्वर की तनु और गर्म HNO3 के साथ अभिक्रिया द्वारा प्राप्त किया जाता है। यह श्वेत, क्रिस्टलीय ठोस है। इसका गलनांक 214°C है। यह जल में शीघ्र विलेय है। इसे रंगीन बोतलों में रखा जाता है क्योंकि सूर्य के प्रकाश की उपस्थिति में यह अपघटित हो जाता है। इसका उपयोग अँगुली पर वोटर निशान बनाने के लिए स्याही के रूप में तथा धोबियों द्वारा कपड़ों पर निशान बनाने वाली स्याही के रूप में, Ag के विद्युत लेपन में, बालों के लिए रजंक बनाने में तथा प्रयोगशाला अभिकर्मक के रूप में किया जाता है।
सोना और इसके यौगिक (Gold and Its Compounds)
सोना (Gold), Au
यह नरम, चमकीली पीली, धात्विक चमक वाली धातु है। इसकी परमाणु संख्या 79 तथा द्रव्यमान संख्या 197 है। यह आवर्त सारणी के समूह 11, आवर्त 6 और d-ब्लॉक में स्थित है। इसका इलेक्ट्रॉनिक विन्यास [Xe]4ƒ14 5d10 6s1 होता है।
सोना प्रकृति में मुक्त अवस्था में या कंछारी निक्षेप (alluvial deposites) में या अयस्कों के रूप में पाया जाता है। सोने का निष्कर्षण केलावेराइट और सिल्वेनाइट अयस्कों [calaverite (AuTe2) and sylvenites (AgAuTe2)] से किया जाता है। इसका निष्कर्षण ऑरीफेरस रेत (auriferrous sand) से अमलगम प्रक्रिया द्वारा भी किया जाता है।
गुण (Properties)
(i) यह भारी धातु है इसका गलनांक और कवथनांक क्रमशः 1064°C तथा 2610°C है। इसका घनत्व 19.7 ग्राम सेमी-3 है ।
(ii) यह अधिकांश अभिकर्मकों के प्रति अक्रिय है लेकिन एक्वा – रेजिया (HCI और HNO3 का 3 : 1 में मिश्रण) में विलेय है।
(iii) यह वायु के प्रति अक्रिय है लेकिन वायु की अधिकता में पोटैशियम और सोडियम सायनाइड से क्रिया करके ऑरोसायनाइड आयन देता है।
(iv) यह इतना कोमल है कि आभूषण बनाने के लिए इसमें कॉपर मिलाया जाता है।
◆ सोने की शुद्धता कैरेट में निरुपित की जाती है। सोने को कठोरता प्रदान करने के लिए इसमें कॉपर मिलाया जाता है। 24 कैरेट सोना शुद्ध है जबकि 23 और 22 कैरेट सोने में 1 तथा 2 भाग (क्रमशः) कॉपर के होते हैं।
उपयोग (Uses)
सोने का उपयोग आभूषण बनाने में, सिक्के बनाने में विद्युत लेपन में तथा चीनी और औषधीय उद्योगों में किया जाता है।
सोने के यौगिक (Compounds of Gold)
पर्पल ऑफ कैसियस (Purple of Cassius),[Au+ Sn (OH)4]
यह पर्पल रंग का कॉलाइडी सोना है इसका नाम जर्मन भौतिकी विज्ञानी कैसियस के नाम पर रखा गया था। यह जल में अविलेय है।
इसका उपयोग रासायनिक यौगिकों में सोने की उपस्थिति ज्ञात करने में तथा रुबी ग्लास तथा मँहगी पर्पल रंग वाले चीनी मिट्टी के समान बनाने में किया जाता है।
जिंक और इसके यौगिक (Zinc and Its Compounds)
जिंक (Zinc), Zn
यह भी एक संक्रमण तत्व है। इसका परमाणु क्रमांक 30 तथा द्रव्यमान संख्या 65 है इसकी खोज 1000 BC पूर्व हुई थी। यह आवर्त सारणी के समूह 12, आवर्त 4 तथा d-ब्लॉक में स्थित है। इसका इलेक्ट्रॉनिक विन्यास 1s2,2s2 2p6,3s2 3p6 3d10, 4s2 होता है। यह संयुक्त अवस्था में जिंक ब्लैंड (ZnS), जिंकाइट (ZnO), कैलेमाइन (ZnCO3), आदि के रूप में पाया जाता है। इसका निष्कर्षण मुख्यतः इसके सल्फाइड अयस्क जिंक ब्लैंड (ZnS) से कार्बन अपचयन विधि द्वारा किया जाता है।
गुण (Properties)
(i) यह नीला सफेद, कडा, भंगुर होता है यह आघातवर्ध्य और तन्य धातु नहीं है।
(ii) इसका गलनांक और क्वथनांक क्रमशः 419°C और 920°C है।
(iii) इसका आपेक्षिक घनत्व 7.1 है। यह ऊष्मा तथा विद्युत का अच्छा चालक है।
(iv) यह तनु HCI, H2SO4 तथा HNO3 से क्रिया करके H2, SO2 तथा NO2 गैस बनाता है।
(v) जिंक NaOH और KOH दोनों से अभिक्रिया करके H2 गैस तथा सोडियम और पोटैशियम जिंकेट क्रमशः बनाता है। यह कॉपर सल्फेट के जलीय विलयन में से कॉपर को विस्थापित कर देता है।
उपयोग (Uses)
(i) जस्तेदार लोहा बनाने में तथा मिश्रधातुएँ बनाने में।
(ii) अनेकों घरेलू उपयोग की वस्तुएँ, हाइड्रोजन गैस तथा युद्ध क्षेत्र में धूम्र पट बनाने में।
(iii) चाँदी और सोना धातुओं के निष्कर्षण में ।
जिंक के यौगिक (Compounds of Zinc )
जिंक सल्फेट (Zinc Sulphate), ZnSO4
सजल जिंक सल्फेट सफेद कसीस (ZnSO4 7H2O) के नाम से जाना जाता है। यह रंगहीन क्रिस्टलीय ठोस है जो कि जल में विलेय है। यह क्षार धातु सल्फेटों और अमोनियम सल्फेट (NH4)2 SO4 के साथ द्विक लवण जैसे K2SO4 .ZnSO3 .6H2O बनाता है। इसका उपयोग रेयॉन के निर्माण में स्कंदक के रूप में, रंगाई, छपाई उद्योगों में, जिंक लेपन में, विद्युत अपघट्य के रूप में, रंजकों में रंग बन्धक के रूप में तथा कैलिको प्रिंटिंग में, जानवरों की त्वचा एवं चमड़े के परिरक्षण में तथा औषधों में संकोचक के रूप में किया जाता है।
लिथोफोन (Lithophone), BaSO4 + ZnS
लिथोफोन, जिंक सल्फेट और बेरियम सल्फाइड की प्रतिक्रिया के फलस्वरूप प्राप्त किया जाता है। इस पर हाइड्रोजन सल्फाइड गैस का कोई प्रभाव नहीं पड़ता है। अतः इसे रंगाई कार्यों में प्रयुक्त किया जाता है। यह अँधेरे में सफेद तथा सूर्य के प्रकाश में धूसर रंग का हो जाता है। यह सफेद पेन्ट और इनेमल बनाने में प्रयुक्त किया जाता है।
पारा और इसके यौगिक (Mercury and Its Compounds)
पारा (Mercury), Hg
इसे सामान्यतः क्विक सिल्वर कहा जाता है। इसकी परमाणु संख्या 80 तथा द्रव्यमान संख्या 200 है। यह आवर्त सारणी के समूह 12, आवर्त 6 तथा d-ब्लॉक में स्थित है। इसका इलेक्ट्रॉनिक विन्यास [Xe] 4ƒ14, 5d10, 6s2 होता है। प्रकृति में यह सिनेबार अयस्क के रूप में पाया जाता है जिससे इसका निष्कर्षण कार्बन-अपचयन प्रक्रम द्वारा किया जाता है।
गुण (Properties)
(i) यह चाँदी जैसी सफेद धातु है जो कक्ष ताप पर द्रव रूप में पाई जाती है।
(ii) 4.12 K ताप पर इसका विद्युतीय प्रतिरोध शून्य हो जाता है तथा यह अतिचालक की तरह कार्य करता है।
(iii) वसा या चीनी के साथ इसका मिश्रण बहुत जोर से हिलाने पर भूरे रंग के पाउडर में परिवर्तित हो जाता है। इसे पारे का मृतकीकरण (deadening of mercury) कहते हैं।
(iv) मर्करी ओजोन के सम्पर्क में आने पर अपना बहाव (meniscus) खो देता है और काँच से चिपकने लगता है ऐसा ऑक्सीकरण के कारण होता है।
(v) यह आयरन और प्लेटिनम को छोड़कर सभी धातुओं के साथ मिश्रधातु बनाता है। अतः इसे लोहे के बर्तनों में रखकर ट्रांसपोर्ट किया जाता है इसके मिश्रधातु अमलगम कहलाते हैं। यह जल, भाप, क्षारों तथा तनु HCl और H2SO4 से अभिक्रिया नहीं करता है।
(vi) यह ठण्डे व तनु HNO3 के साथ क्रिया करके मयूरस नाइट्रेट और NO बनाता है लेकिन सान्द्र HNO3 के साथ यह मक्यूरिक नाइट्रेट NO तथा NO2 बनाता है।
(vii) यह ऐक्वा-रेजिया में भी विलेय है। यह क्लोरीन और सल्फर से अभिक्रिया करके क्रमशः मर्कयूरिक क्लोराइड (MgCl2) तथा मक्यूरिक सल्फाइड देता है।
उपयोग (Uses)
(i) थर्मामीटर, बैरोमीटर, अमलगम और प्रसाधन उत्पाद जैसे – मस्कारा, आदि में ।
(ii) मर्करी लैम्प, प्रदीपक लैम्प और ट्यूब लाइट में (मर्करी वाष्प + Ar) ।
(iii) विद्युतीय कनेक्शन में सम्पर्क द्रव के रूप में।
(iv) गोल्ड और सिल्वर के निष्कर्षण में तथा वर्मीलियन (vermillion) के निर्माण में ।
(v) LCD स्क्रीन, बैटरियों तथा मापन और नियन्त्रण युक्तियों में।
पारे के यौगिक (Compounds of Mercury)
मयूरिक सल्फाइड (Mercuric Sulphide), HgS
यह लाल रंग का क्रिस्टलीय ठोस है जिसे वर्मीलियन (vermillion) भी कहते हैं। यह जल में अविलेय है तथा अम्ल से क्रिया नहीं करता है । ऐक्वा-रेजिया से उपचारित करने पर यह घुलकर मक्यूरिक क्लोराइड (HgCl2) देता है। इसका उपयोग औषधियों में मकरध्वज के रूप में तथा जल रंगों के निर्माण में किया जाता है।
मयूरस क्लोराइड (Mercurous Chloride), Hg2Cl2
मर्करी (I) क्लोराइड श्वेत ठोस है जो जल में अमिश्रणीय है उसे कैलोमल भी कहते है इसका उपयोग पेट साफ करने वाली औषधि बनाने में तथा कैलोमल इलेक्ट्रोड (reference electrode) बनाने में किया जाता है।
मयूरिक क्लोराइड (Mercuric Chloride), HgCl2
यह क्रिस्टलीय रंगहीन ठोस है जो कोरोसिव सब्लिमेट (corrosive sublimate) के नाम से जाना जाता है। यह विषैला है तथा इसका सर्वश्रेष्ठ प्रतिविष (विषहर) अण्डे की सफेदी है। यह ठण्डे जल में साधारण विलेय है लेकिन गर्म जल में शीर्घ विलेय है। इसका उपयोग नेसलर अभिकर्मक में, [(K2HgI4) का क्षारीय वियलन (NaOH में विलयन) का प्रयोग अमोनिया या अमोनियम आयन की उपस्थिति ज्ञात करने में किया जाता है।], कीटाणुनाशक के रूप में सर्जिकल यन्त्रों के निस्संक्रमण में, चमड़ा, लकड़ी को सुरक्षित रखने में, मयूरिक लोशन तथा कैलोमल बनाने में, चमड़ा पकाने, शुष्क बैटरी, टेक्सटाइल प्रिंटिग, आदि में किया जाता है।
लेड और इसके यौगिक (Lead and Its Compounds)
लेड (Lead), Pb
लेड (सीसा) एक मुलायम, नीलापन लिए सफेद रंग की धातु है जो वायु के साथ क्रिया कर निस्तेज धूसर रंग देती है। यह सर्वाधिक स्थाई तत्व है। इसका परमाणु क्रमांक 82 तथा द्रव्यमान संख्या 207 है। यह आवर्त सारणी के समूह 14 (या IV A), आवर्त 6 और p-ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास [Xe] 4ƒ14, 5d10, 6s2 6p2 होता है। सामान्यता यह संयुक्त अवस्था में पाई जाती है। इसका निष्कर्षण गैलेना (PbS) अयस्क से स्वतः अपचयन या कार्बन द्वारा या कार्बन मोनॉक्साइड द्वारा अपचयन से किया जाता है। शुद्ध लेड बेट्स विद्युत अपघटन प्रक्रम (Betts electrolytic process ) द्वारा प्राप्त की जाती है।
गुण (Properties)
(i) यह एक उभयधर्मी धातु है इसका गलनांक और क्वथनांक 327°C और 1620°C है।
(ii) यह अधिक आघातवर्ध्य लेकिन कम तन्य धातु है।
(iii) यह भारी धातु है इसका घनत्व 11.34 ग्राम सेमी-3 है।
(iv) यह शुष्क वायु के प्रति अक्रिय है लेकिन नम वायु से क्रिया करके प्रथम हाइड्रॉक्साइड की परत तत्पश्चात कार्बोनेट की परत बनाती है।
(v) गर्म करने पर यह वायु की ऑक्सीजन से क्रिया करके ऑक्साइड तथा क्लोरीन के साथ यह क्लोराइड (PbCl2) बनाती है। सल्फर के साथ यह सल्फाइड (PbS) तथा सान्द्र H2SO4 से क्रिया करके लेड सल्फेट और SO2 गैस बनाती है।
(vi) यह तनु HCl तथा तनु H2SO4 से क्रिया नहीं करती है। यह सान्द्र HCl से क्रिया करके H2 गैस मुक्त करती है।
(vii) यह क्षारों (NaOH) से क्रिया करके प्लमबेट बनाती है तथा H2 भी मुक्त करती है।
(viii) तनु HNO3 के साथ यह नाइट्रिक ऑक्साइड (NO) तथा सान्द्र HNO3 के साथ यह भूरे रंग की NO2 गैस बनाता है।
उपयोग (Uses)
(i) लेड चेम्बर, पाइप लेड स्टोरेज बैटरी, लेड आर्सेनिक बुलेट, बुलेट तथा मिश्र धातु, आदि के निर्माण में तथा विद्युत केबल के आच्छादन में।
(ii) रेडियो सक्रिय खनिजो से उत्सर्जित हानिकारक विकिरणों से बचाव में तथा इलेक्ट्रॉनिक सर्किट बोर्ड और अन्य इलेक्ट्रॉनिक उपकरणों में टाँका लगाने में (in soldering)।
लेड की मिश्रधातु (Alloys of Lead)
प्यूटर – Sn (75%) तथा Pb (25%)
सोल्डर – Sn (50-70%) तथा Pb (50-30%)
टाइपमेटल – Pb (75%), Sb (20%) तथा Sn (5%)
◆ आजकल पीने के पानी की आपूर्ति के लिए लेड के पाइपों का उपयोग करने पर प्रतिबन्ध है क्योंकि यह जल के साथ विषैले पदार्थ बनाती है।
लेड के यौगिक (Compounds of Lead)
लेड ऑक्साइड या लिथार्ज (Lead Oxide or Litharge), PbO
इसे लेड नाइट्रेट को गर्म करके प्राप्त किया जाता है। यह पीले रंग का वाष्पशील उभयधर्मी ऑक्साइड है। इसका उपयोग लेड स्टोरेज बैटरी के निर्माण में तथा फ्लिण्ट काँच के निर्माण में किया जाता है।
लाल लेड या मिनियम या सिन्दूर (Red Lead or Minium or Sindhur), Pb3O4
इसका रासायनिक नाम ट्राइप्लम्बिक टेट्राऑक्साइड है। यह लाल रंग का चूर्ण है जो जल में अविलेय है। यह लिथार्ज को वायु में 470°C पर गर्म करके प्राप्त किया जाता है। इसका उपयोग लाल पेंसिल, लाल पेंट के निर्माण में, दियासलाई बनाने में, लाल वर्णक के रूप में, काँच उद्योग में तथा आयरन और स्टील के लिए रक्षक पेन्ट बनाने में किया जाता है।
टेट्राएथिल लेड (Tetraethyl Lead), Pb(C2H5)4–
यह रंगहीन गतिशील द्रव है। वाहनों में जरा सी मात्रा में डाले जाने पर यह पेट्रोल के अपस्फोटन को रोकता है। अतः इसे अपस्फोटनरोधी कारक (anti-knocking agent) भी कहते हैं। TEL सहित पेट्रोल लाल रंग का होता है तथा लेड पेट्रोल (leaded petrol) या एथिल पेट्रोल कहलाता है।
लेड कार्बोनेट या व्हाइट लेड (Lead Carbonate or White Lead), PbCO3
यह जल में अविलेय लेकिन अम्लों जैसे HCl तथा HNO3, आदि में विलेय है। इसका उपयोग सफेद वर्णक बनाने में किया जाता है।
लेड ऐसीटेट (Lead Acetate), Pb(CH3COO)2
यह श्वेत क्रिस्टलीय ठोस है तथा जल में विलेय है। इसके क्रिस्टलों का स्वाद मीठा होता है। अतः इसे लेड की शर्करा (sugar of lead) या अकार्बनिक शर्करा (inorganic sugar) कहते हैं।
उपयोग (Uses)
इसका उपयोग H2S की उपस्थिति ज्ञात करने में तथा रंग बन्धक के रूप में किया जाता है।
यूरेनियम (Uranium), U
यह चाँदी जैसा सफेद तत्व है। इसका परमाणु क्रमांक 92 तथा द्रव्यमान संख्या 238 है। इस तत्व की खोज जर्मन रसायनज्ञ एम.एच क्लाप्रोथ ने की थी। यह आवर्त सारणी के समूह 3, आवर्त 7 तथा ƒ- ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास [Rn] 5ƒ3, 6d1, 7s2 होता है। यह मुक्त अवस्था में नहीं पाया जाता है तथा इसका निष्कर्षण पिच ब्लैण्ड (pitch blende) अयस्क से किया जाता है। इसके छह रेडियोसक्रिय समस्थानिक हैं।
232U, 233U, 234U, 235U, 236U, 238U इनमें से 238U प्रकृति में सर्वाधिक (99.98% ) पाया जाता है जबकि 235U (0.71%) तथा 234U (0.006%) बहुत कम मात्रा में पाया जाता है। केवल 235U समस्थानिक ही विखण्डनीय है। अतः इसका उपयोग नाभिकीय ईंधन के रूप में परमाणु रिऐक्टर में किया जाता है।
गुण (Properties)
(i) यह अनुचुम्बकीय है इसका घनत्व 19.05 ग्राम सेमी-3 है।
(ii) इसका गलनांक तथा क्वथनांक क्रमशः 1850°C तथा 3500°C है।
(iii) अशुद्ध रूप में यह भंगुर है
(iv) इसे metal of hope भी कहते हैं ।
◆ यूरेनियम ऑक्साइड की येलो केक (yellow cake) के नाम से सीमा पार तस्करी की जाती है संवर्धित यूरेनियम (enriched uranium) का उपयोग अवैध नाभिकीय विस्फोटकों के निर्माण में किया जाता है जो कि मानवता के लिए खतरा है।
उपयोग (Uses)
इसका उपयोग आर्मी सेक्टर में, नाभिकीय रिऐक्टरों तथा अन्य रिसर्च नाभिकीय रिऐक्टरों में ईंधन के रूप में, फोटोग्राफी में यूरेनियम नाइट्रेट तथा यूरेनियम ऐसीटेट के रूप में औषधियों के निर्माण में यूरेनियम के नाइट्रेट, क्लोराइड और सेलिसायलेट के रूप में, गैस विसर्जन उपकरणों में इलेक्ट्रोड के रूप में, मिश्रधातुओं के निर्माण में, नाभिकीय आयुधास्त्रों (जैसे एटम बम, मिसाइल, आदि) के निर्माण में तथा अमोनिया उत्पादन की हैबर विधि में यूरेनियम कार्बाइड के रूप में किया जाता है।
प्लेटिनम (Platinum), Pt
यह उत्कृष्ट धातु है। इसका परमाणु क्रमांक 78 तथा द्रव्यमान संख्या 195 है। यह आवर्त सारणी के समूह 10, आवर्त 6 तथा d-ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास [Xe] 4ƒ14, 5d9, 6s1 होता है। इसे सफेद सोना (white gold) या एडम उत्प्रेरक भी कहते हैं यह वायु तथा अम्लों के प्रति अक्रिय है। इसका उपयोग मिश्र धातु, फाउनटेन पैन की निब की टिप, प्रयोगशाला युक्तियों, आभूषणों तथा ओस्टवॉल्ड प्रक्रम में उत्प्रेरक के रूप में किया जाता है।
थोरियम ( Thorium), Th
नथा यह प्राकृतिक रेडियोसक्रिय तत्व है जो मुक्त अवस्था में नहीं पाया जाता है लेकिन यह समुद्र तट के पास मोनाजाइट के रूप में पाया जाता है। इसके क्रिस्टलों की आकृति अष्टफलकीय है। थोरियम का परमाणु क्रमांक 90 तथा इसकी द्रव्यमान संख्या 232 है। यह आवर्त सारणी के समूह 3, आवर्त 7 तथा ƒ-ब्लॉक का तत्व है। इसका इलेक्ट्रॉनिक विन्यास [Rn] 6d2 7s2 होता है। यह भूरे रंग की धातु है इसका गलनांक तथा क्वथनांक क्रमशः 1145°C तथा 2800°C है। इसका घनत्व 11.23 ग्राम सेमी-3 है। इसका उपयोग मेग-थोर मिश्र के रूप में एयरक्राफ्ट इंजिन और रॉकेट में, नाभिकीय ऊर्जा के उत्पादन में, टंगस्टन तन्तु और आर्क लैम्प में, कार्बनिक रसायन में उत्प्रेरक के रूप में, फोटोइलेक्ट्रिक सेल, ग्लो ट्यूब इलेक्ट्रोड, इनकेन्डीसेन्ट गैस मेन्टल्स में किया जाता है।
प्लूटोनियम (Plutonium), Pu
यह मानव निर्मित कृत्रिम रेडियोऐक्टिव तत्व है। इसका परमाणु क्रमांक 94 तथा द्रव्यमान संख्या 244 है। इसका इलेक्ट्रॉनिक विन्यास [Rn] 5ƒ6, 6d0, 7s2 होता है।
उपयोग (Uses)
(i) इसका उपयोग नाभिकीय विखण्डन बमों को बनाने में किया जाता है। जापान के हिरोशिमा और नागासाकी शहरों पर गिराये गए बम क्रमशः U- 235 तथा Pu – 239 से बने थे।
(ii) रिसर्च नाभिकीय रिऐक्टरों में प्लूटोनियम का उपयोग किया जाता है।
हमसे जुड़ें, हमें फॉलो करे ..
- Telegram ग्रुप ज्वाइन करे – Click Here
- Facebook पर फॉलो करे – Click Here
- Facebook ग्रुप ज्वाइन करे – Click Here
- Google News ज्वाइन करे – Click Here